| Benzènehexol | |
| |
| Identification | |
|---|---|
| Nom UICPA | benzène-1,2,3,4,5,6-hexol |
| Synonymes |
hexahydroxybenzène |
| No CAS | |
| No ECHA | 100.204.877 |
| PubChem | 69102 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
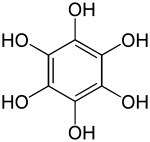
| Formule | C6H6O6 [Isomères] |
| Masse molaire[1] | 174,108 2 ± 0,007 g/mol C 41,39 %, H 3,47 %, O 55,14 %, |
| Propriétés physiques | |
| T° fusion | 200 °C [2] 310 °C[3] |
| Précautions | |
| SGH[4] | |
| H315, H319, P264, P280, P362, P302+P352, P305+P351+P338, P332+P313 et P337+P313 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le benzènehexol ou hexahydroxybenzène est un composé aromatique de formule C6H6O6 ou C6(OH)6. Il consiste en un noyau benzénique entièrement substitué par des groupes hydroxyle, c'est le sextuple alcool du benzène[3],[5]. Ce composé est aussi appelé hexaphénol[6], mais ce nom a aussi été utilisé pour d'autres substances[7].
Le benzènehexol est un solide cristallin soluble dans l'eau chaude[6] et qui possède un point de fusion supérieur à 310 °C[3]. Il peut être préparé de l'inositol (cyclohexanehexol). Son oxydation produit du tétrahydroxy-1,4-benzoquinone (THBQ) puis de l'acide rhodizonique et du dodécahydroxycyclohexane[8]. Inversement, le benzènehexol peut être obtenu par réduction du sel de sodium de THBQ avec un mélange SnCl2 et HCl[9].
Le benzènehexol est un composé de départ pour les cristaux liquides discotiques[9]. Il forme aussi un adduit de ratio 2:1 avec la 2,2'-bipyridine[10].
Benzènehexolate
Comme la plupart des phénols, le benzènehexol peut perdre six ions H+ de ses groupes hydroxyle formant l'hexanion C6O66−. le sel de potassium de cet anion est un des composants du « potassium carbonyl » de Liebig, issu de la réaction du monoxyde de carbone, CO avec du potassium, K. L'hexanion peut être produit de la trimérisation d'anions éthynediolates, C2O22− en chauffant de l'éthynediolate de potassium, K2C2O2[11]. La nature exacte de K6C6O6 a été clarifiée par B. Nietzki et T. Benckiser en 1885 qui trouvèrent que son hydrolyse produit du benzènehexol[12],[13],[14].
Le sel benzènehexolate de lithium, Li6C6O6 a été considéré pour des applications dans les piles électriques[15].
Ester
Le benzène hexol forme des esters comme l'hexaacétate, C6O6(-O(CO)CH3)6 (p.f. 220 °C) et des éthers comme l'hexa-tert-butoxybenzène, C6O6(-OC(CH3)3)6 (p.f. 223 °C)[11].
Il forme aussi des esters d'acide oxalique ou d'acide carbonique qui sont de fait des oxydes de carbone comme le trisoxalate d'hexahydroxybenzène ou le triscarbonate d'hexahydroxybenzène.
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Benzenehexol » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) J. Rosinski et A. Lecinski, « Further studies of heterogeneous nucleation of ice at the liquid-liquid interface », The Journal of Physical Chemistry, vol. 85, no 20, , p. 2993-2997 (DOI 10.1021/j150620a029)
- A. J. Fatiadi and W. F. Sager, Hexahydroxybenzene (Benzenehexol), Organic Syntheses, 1973, coll. col. 5, p. 595
- (de) Hexahydroxybenzol chez TCI Europe
- Gerd Leston, (Polyhydroxy)benzenes, Kirk‑Othmer Encyclopedia of Chemical Technology, John Wiley & Sons, 1996. DOI 10.1002/0471238961.1615122512051920.a01.
- J.I.G. Codagan, John Buckingham, Finlay J. MacDonald, P. H. Rhodes, Dictionary of organic compounds, CRC Press, 1996. (ISBN 0-412-54090-8), (ISBN 978-0-412-54090-5).
- (en) HEXAPHENOL Basic information. Chemical Book.
- (en) Alexander J. Fatiadi, Horace S. Isbell et William F. Sager, « Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol) », Journal of Research of the National Bureau of Standards A: Physics and Chemistry, vol. 67A, no 2, , p. 153–162 (lire en ligne)
- Sandeep Kumar, Self-organization of disc-like molecules: chemical aspects, Chem. Soc. Rev., 2006, vol. 35, pp. 83–109. DOI 10.1039/b506619k.
- John A. Cowan, Judith A. K. Howard, Michael A. Leech, Horst Puschmann and Ian D. Williams, Hexahydroxybenzene—2,2'-bipyridine (1/2), Acta Crystallographica Section C, 2001, vol. C57, pp. 1194–1195.
- Fèlix Serratosa, Acetylene Diethers: A Logical Entry to Oxocarbons, Acc. Chem. Res., 1983, vol. 16, pp. 170-176. DOI 10.1021/ar00089a004.
- B. Nietzki and T. Benckiser, Berichte Chemie, 1885, vol. 18, p. 1834.
- Ludwig Mond, On metallic carbonyls, Proceedings of the Royal Institution, 1892, vol. 13, pp. 668-680. Reprint in The Development of Chemistry, 1789-1914: Selected essays édité par D. Knight,1998. (ISBN 0-415-17912-2), version en ligne.
- Werner Büchner, E. Weiss, Zur Kenntnis der sogenannten «Alkalicarbonyle» IV[1] Über die Reaktion von geschmolzenem Kalium mit Kohlenmonoxid", Helvetica Chimica Acta, 1964, vol. 47(6), pp. 1415–1423. DOI 10.1002/hlca.19640470604.
- Haiyan Chen, Michel Armand, Matthieu Courty, Meng Jiang, Clare P. Grey, Franck Dolhem, Jean-Marie Tarascon, and Philippe Poizot, Lithium Salt of Tetrahydroxybenzoquinone: Toward the Development of a Sustainable Li-Ion Battery, J. Am. Chem. Soc., 2009, vol. 131(25), pp. 8984–8988. DOI 10.1021/ja9024897.









