
Le système immunitaire adaptatif comprend les lymphocytes T, qui contribuent à l'immunité à médiation cellulaire, et les lymphocytes B, qui sont responsables de l'immunité à médiation humorale. Ces deux populations cellulaires ont des propriétés et des fonctions distinctes des cellules du système immunitaire inné.
Il existe deux caractéristiques majeures propres à l'immunité adaptative :
- les gènes codant les récepteurs antigéniques des lymphocytes font l'objet d'une recombinaison somatique et aléatoire de l'ADN, appelée recombinaison somatique ; la nature des récepteurs antigéniques des lymphocytes n'étant pas entièrement prédéterminée génétiquement, l'immunité adaptative est également appelée immunité acquise ;
- l'activation d'un lymphocyte s'accompagne d'une expansion clonale (permettant d'amplifier la réponse immunitaire spécifique à l'antigène) et de la mise en place d'une réponse mémoire, ou anamnestique (sur laquelle repose le principe de la vaccination). C'est en cela que l'on parle d'immunité adaptative.
Le système immunitaire adaptatif permet de construire au cours de la vie une immunité acquise qui, avec le système immunitaire inné, constitue le phénotype immunitaire des individus.
Apparu chez les poissons cartilagineux il y a 500 millions d'années, le système immunitaire adaptatif n’existe que chez les agnathes (vertébrés dépourvus de mâchoires) et les gnathostomes (vertébrés à mâchoires)[1].
Caractéristiques du système immunitaire adaptatif
[modifier | modifier le code]
L'immunité adaptative est activée à la suite de la reconnaissance d'agents infectieux par le système immunitaire inné[2]. Bien que l'immunité innée permette de reconnaître des familles de pathogènes grâce à des récepteurs spécifiques dont il existe plusieurs types correspondant à plusieurs classes de pathogènes, elle ne peut pas reconnaître une espèce particulière : par exemple, elle peut reconnaître les bactéries Gram négatives, mais elle ne peut pas distinguer quelle espèce de Gram négative provoque l'infection.
L'immunité adaptative est spécifique pour une espèce donnée et a un mécanisme de mémoire. Le système immunitaire adaptatif permet d'amplifier la réponse immunitaire et confère à la fois une réponse spécifique à l'antigène, et donc particulièrement adaptée à l'agent infectieux, et une réponse mémoire permettant une élimination plus efficace du même agent infectieux si l'organisme y est de nouveau confronté[3]. Les cellules de l'immunité adaptative constituent ainsi un complément essentiel de la réponse immunitaire innée.
Spécificité et mémoire sont les deux caractéristiques principales du système immunitaire adaptatif.
Une autre caractéristique importante de l'immunité adaptative est la nécessité de mettre en jeu un nombre important de cellules spécifiques pour combattre un agent pathogène spécifique. Cette multiplication spécifique est l'expansion clonale. Elle nécessite plusieurs jours, ce qui explique que les effets de l’immunité adaptative n'apparaissent qu'au bout d'environ sept jours.
Production du répertoire immunitaire
[modifier | modifier le code]Qu'est-ce que le répertoire immunitaire ?
[modifier | modifier le code]Au début du XXe siècle, les biologistes pensaient que, au vu du nombre très important de pathogènes possibles, il n'était pas possible pour l'organisme de produire, à l'avance, des récepteurs pour tous les antigènes pathogènes. Les biologistes pensaient que la pénétration d'un microbe entraînait une production par l'organisme de récepteurs capables de reconnaître le microbe, puis que dans un second temps ces récepteurs nouvellement synthétisés signalaient la présence d'un microbe aux lymphocytes qui produisaient enfin des anticorps. Cette théorie était nommée la théorie interventionniste. Cette théorie est fausse.
L'organisme produit à l'avance des récepteurs pour tous les microbes présents et à venir. Si cette production dépendait du génome présent dans les lymphocytes, la taille du génome lymphocytaire contenant moins de 25 000 gènes serait insuffisante. Il faudrait des millions de gènes pour stocker autant d'information.
L'organisme peut fabriquer des milliards de récepteurs grâce à un mécanisme nommé la recombinaison somatique qui se produit dans l'ADN des lymphocytes B et T se trouvant dans les ganglions. La production des récepteurs des lymphocytes B et T s’accompagne de modifications de l'ADN de ces lymphocytes.
Le répertoire immunitaire est l'ensemble formé par les lymphocytes B et T ayant un récepteur membranaire spécifique pour un pathogène. Seule une partie du répertoire des lymphocytes peut reconnaître un antigène donné, par conséquent seule une partie du répertoire des lymphocytes est activée par un antigène donné dans un contexte infectieux.
Immunoglobulines
[modifier | modifier le code]Les immunoglobulines sont des structures protéiques dont il existe deux formes : les immunoglobulines membranaires au niveau des lymphocytes B naïfs qui vont recevoir l’antigène du pathogène et les immunoglobulines solubles qui sont sécrétées dans le plasma par les plasmocytes (cellules dérivant des lymphocytes B). Les immunoglobulines solubles sont nommées anticorps et vont se fixer sur le pathogène.
L'immunoglobuline est formée de deux chaînes protéiques : la chaîne lourde et la chaîne légère.

Il existe cinq classes, parfois nommées isotypes, d'immunoglobulines désignées par une lettre de l'alphabet (cette lettre de l’alphabet est en fait la première lettre du nom de la lettre grecque donnée par les biologistes à chaque chaîne lourde) : immunoglobuline A, immunoglobuline D, immunoglobuline E, immunoglobuline G, immunoglobuline M.
Les immunoglobulines membranaires se fixent au niveau des lymphocytes B naïfs par une petite zone : la zone d'ancrage membranaire (B Cell Receptor). La portion verticale d'une immunoglobuline, constituée uniquement de chaîne lourde, est nommée domaine Fc. Le domaine Fc détermine la fonction de l'immunoglobuline : c'est par exemple sur cette partie que se fixent les protéines du système de complément et les cellules ayant une action phagocytaire comme les récepteurs Fc d'un macrophage (Fc Receptor). C'est sur l’extrémité des portions variables que sont reconnus les antigènes du pathogène.
L’immunoglobuline se divise en deux régions : la région constante (en violet sur le schéma) identique pour toutes les immunoglobulines de la même classe et une région variable (en vert sur le schéma). La synthèse (formation) de la partie variable est un processus complexe car elle comporte une région hypervariable (à l’extrémité de la région variable) nommée CDR (Complementary Determining Regions) où se fixe l’antigène.
Antigène
[modifier | modifier le code]Un antigène est toute molécule reconnue par les lymphocytes B ou T par l'intermédiaire des immunoglobulines sécrétoires et/ou membranaires. Les parties de l'antigène qui sont reconnues par un anticorps sont appelées épitopes et la partie de l'anticorps reconnaissant l'épitope est appelée paratope. La plupart des antigènes comportent plusieurs épitopes.
La plupart des molécules, protéines, glycoprotéines, polysaccharides, lipoprotéine, lipopolysacharide, acides nucléique peuvent être des antigènes. C'est même le cas pour des substances chimiques comme les métaux lourds ou les narcotiques.
Différents types d'antigène
[modifier | modifier le code]Les auto antigènes sont des antigènes qui font partie de son propre corps : ce sont les antigènes du soi.
Les antigènes qui n'appartiennent pas à son propre corps sont les antigènes du non soi dont il existe deux catégories :
- ceux appartenant à une espèce différente, les exogènes (antigène venant de l'extérieur) ;
- ceux appartenant à la même espèce, les allogènes. Les allogènes déclenchent le rejet du greffon dans les transplantations d'organe ou sont responsables des réactions lors de la transfusion d'un groupe sanguin n'appartenant pas au même groupe que le receveur.
Immunogénicité
[modifier | modifier le code]L'immunogénicité est la capacité d'un antigène à produire une réponse par le système adaptatif. Certains antigènes ne produisent pas de réponse immunitaire. On nomme haptène un antigène de faible masse moléculaire qui a besoin d'un porteur pour provoquer une réponse immunitaire du système adaptatif.
Partie variable de l'immunoglobuline
[modifier | modifier le code]Pour que la réponse immunitaire adaptative reconnaisse, élimine, et se « rappelle » les multiples antigènes exprimés par les multiples agents infectieux rencontrés au cours de l'existence, le système immunitaire doit pouvoir reconnaître un très grand nombre d'antigènes différents. Un être humain est à priori capable de produire près de mille milliards d'anticorps différents.
La multitude des récepteurs antigéniques est produite par un processus appelé sélection clonale. Selon la théorie de la sélection clonale, à la naissance, un animal génère de façon aléatoire une immense diversité de lymphocytes dont chacun exprime un récepteur antigénique unique à partir d'un nombre limité de gènes. Afin de générer des récepteurs antigéniques uniques, ces gènes sont soumis au processus de recombinaison somatique, durant lequel chaque segment de gène se recombine avec l'autre pour former un gène unique. Le produit de ce gène donne ainsi un récepteur antigénique ou un anticorps unique pour chaque lymphocyte, avant même que l'organisme soit confronté à un agent infectieux, et prépare l'organisme à reconnaître un nombre quasiment illimité d'antigènes différents.

Différentes classes
[modifier | modifier le code]Il existe cinq classes ou isotypes d'immunoglobulines. Cette classification dépend de la zone constante de l'immunoglobuline (violet).
L'immunoglobuline D n’existe que sous forme membranaire. Il n’existe pas d'immunoglobulines D solubles (dans le sang).
L'immunoglobuline M présente une forme sécrétée différente de la forme membranaire. L'immunoglobuline M soluble est formée de cinq immunoglobulines M, ou pentamères. Chaque pentamère a donc dix sites de reconnaissance antigénique, ce qui rend cette immunoglobuline particulièrement efficace pour la reconnaissance des antigènes pathogènes.
Les immunoglobulines D et les immunoglobulines M sont les immunoglobulines retrouvées à la surface des lymphocytes B naïfs.
L'immunoglobuline A dans sa forme soluble est un dimère. La liaison reliant les deux immunoglobulines se nomme la chaîne J. C'est l'anticorps le plus présent dans les muqueuses respiratoires, digestives et génitales[4].
Les immunoglobulines E et G sont sécrétées sous forme de monomères.
Avidité des anticorps
[modifier | modifier le code]L'avidité des anticorps est une notion très importante. L’avidité est la capacité (force de liaison) d'un anticorps à se fixer sur un antigène.
L’avidité de l'anticorps dépend de deux facteurs :
- l'affinité de l'anticorps qui est la probabilité (pourcentage) de l'anticorps de se fixer sur un antigène. Cette probabilité de se fixer dépend de la région hypervariable (à l’extrémité de la région variable) nommée CDR ;
- le nombre de sites antigéniques que porte l'anticorps. Le nombre de sites antigéniques est nommé valence en immunologie. Les immunoglobulines D, E, G ont deux sites antigéniques, l'immunoglobuline A a quatre sites antigéniques et l'immunoglobuline M en a dix.
L'avidité des immunoglobulines G est très utilisée pour déterminer la datation d'une infection virale (rubéole, varicelle, etc.) ou parasitaire (toxoplasmose) chez la femme enceinte. Une avidité forte signale une infection ancienne. On élimine ainsi l'hypothèse d'une infection en début de grossesse en situant l'infection avant la grossesse. L'apparition d'une avidité forte des immunoglobulines varie en fonction de l'infection. Par exemple, pour les anticorps toxoplasmiques, l'avidité devient forte 4 mois après l'infection. Une avidité forte des anticorps toxoplasmiques chez une femme enceinte de 10 semaines (2,5 mois) suspectée d'infection toxoplasmique en début de grossesse indique que cette infection a eu lieu avant la grossesse.

Structure des récepteurs des lymphocytes B et T
[modifier | modifier le code]Récepteurs des lymphocytes B ou BCR
[modifier | modifier le code]Rappelons que les lymphocytes B sont responsables de l'immunité humorale par production d'anticorps. Cette immunité s'attaque surtout au microbe extracellulaire ou avant que celui-ci pénètre dans la cellule comme les virus.
Le BCR est le récepteur situé à la surface des lymphocytes B naïfs (avant toute stimulation par un microbe). Le site de fixation de l’antigène est une immunoglobuline membranaire fixée par une petite zone : la zone d'ancrage membranaire (B Cell Receptor). Cette zone ne pénètre pas dans la cellule. Le BCR est incapable à lui seul de signaler à la cellule qu'un microbe s'est fixé sur lui. Les immunoglobulines des BCR des lymphocytes B naïfs sont des immunoglobulines M et D[5].
L'immunoglobuline membranaire a besoin d'un corécepteur pour signaler la présence d'un microbe : le CD79. Il est formé de deux chaînes : alpha et bêta. À l'intérieur de la cellule, le CD79 possède une zone nommée ITAM (motif d'activation des récepteurs immuns basé sur la tyrosine ou (Immunoreceptor Tyrosine-based Activation Motif) qui permet de signaler la présence d'un microbe par phosphorisation[6],[7],[8].

Récepteurs des lymphocytes T ou TCR
[modifier | modifier le code]
Rappelons que les lymphocytes T sont responsables de l'immunité cellulaire. Cette immunité s'attaque surtout au microbe intracellulaire.
Le TCR est composé de deux parties :
- Le site de fixation de l’antigène est composé de deux chaînes : alpha et beta, avec une partie variable et une partie constante. Ce site, à la différence du site antigénique des BCR, ne reconnaît qu'un type de molécule, les peptides, et à condition que ceux-ci soient présentés par un complexe majeur d’histocompatibilité (CMH). Cette complexité assure que l'organisme ne réagit pas contre ses propres peptides[9].
- Le TCR a aussi besoin d'un corécepteur pour signaler la présence d'un microbe. Le nom de ce corécepteur est le CD3. Le CD3 est un groupe de protéines invariables composé de deux chaînes epsilon externes, d'une chaîne alpha et d'une chaîne bêta internes. Le corécepteur a deux fonctions : il est requis pour amener le TCR à la surface et il transmet les signaux d'activation lors de la reconnaissance du complexe peptide-CMH par le TCR. Comme pour le corécepteur du BCR, il existe des zones ITAM intracellulaires[10].
Génération des récepteurs des lymphocytes T et B
[modifier | modifier le code]Une organisation particulière des gènes au niveau des chromosomes et un processus particulier nommé recombinaison somatique permettent la formation d'un répertoire immense de récepteurs. La recombinaison somatique est un processus qui permet de joindre différents gènes localisés sur un chromosome. Cette recombinaison est sous le contrôle de deux enzymes : les recombinases RAG1 et RAG2[11].
Maturation des récepteurs des lymphocytes T et B
[modifier | modifier le code]La question centrale de l'immunité adaptative est de comprendre pourquoi les immunoglobulines (anticorps) et les lymphocytes T ne s'attaquent pas aux propres antigènes de l'organisme qui les produit. Des mécanismes spécifiques interviennent pendant la maturation des cellules immunitaires pour éliminer celles susceptibles de reconnaître et d'attaquer les constituants du corps lui-même, assurant ainsi une tolérance immunitaire.
Maturation des récepteurs des lymphocytes B
[modifier | modifier le code]
La maturation des cellules B se produit dans la moelle osseuse. La cellule souche donne un lymphocyte B selon des étapes bien définies :
- Pro B où se forme la chaîne lourde de l'immunoglobuline M avec recombinaison somatique pour sa partie variable des récepteurs cellulaires ;
- Pre B où la chaîne lourde apparaît à la surface de la cellule. À ce stade, un premier contrôle est fait : les cellules n'ayant pas la chaîne lourde sont détruites par apoptose ;
- Immature B où se forme la chaîne légère avec recombinaison somatique pour sa partie variable et formation d'un récepteur B complet de type immunoglobuline M. À ce stade, un deuxième contrôle est fait : les cellules n'ayant pas la chaîne légère (ou si celle-ci est de mauvaise qualité) sont détruites par apoptose ;
- Mature B où un deuxième type de récepteur apparaît, l'immunoglobuline D, par épissage alternatif. Les lymphocytes matures sont testés pour la réactivité au soi. Les lymphocytes B présentant une réactivité aux antigènes de la personne sont éliminés. Il existe aussi un autre processus appelé révision du récepteur (receptor binding) pour le lymphocyte B présentant une réactivité aux antigènes de la personne avec désactivation de la chaîne légère des immunoglobulines et fabrication d'une nouvelle chaîne légère par réactivation des enzymes RAG1 et RAG 2.
Ce processus de formation du répertoire des lymphocytes B par élimination est appelé sélection négative.
La formation des récepteurs nécessite aussi un contrôle allélique, c'est-à-dire que les gènes impliqués dans la formation des chaînes lourdes et légères soient toujours d'origine maternelle ou paternelle.
Maturation des récepteurs des lymphocytes T
[modifier | modifier le code]La maturation des cellules T se produit dans le thymus. Elle obéit aux mêmes règles que celles du lymphocyte B pour la formation du récepteur des lymphocytes T. La seule exception est que dans cette maturation, à côté de la sélection négative, il existe une sélection positive. Cette sélection consiste à faire reconnaître par l'organisme les lymphocytes T réagissant à la présentation d'un peptide présenté par un MHC[12]
Le récepteur TCR se doit de reconnaître à la fois le peptide présenté par le MHC et le type de MHC : le type I pour les MHC que possèdent toutes les cellules de l'organisme et le type II qui existe seulement dans les macrophages, les lymphocytes B et les cellules dendritiques. Cette reconnaissance du type de MHC se fait grâce à des corécepteurs présents à la surface des lymphocytes T, le corécepteur CD4 pour les MHC de type II, le corécepteur CD8 pour les MHC de type I. La maturation des cellules T au niveau du thymus est régie par l'expression des corécepteurs CD4 et CD8 au niveau des lymphocytes T : les cellules n'exprimant ni CD4 ni CD8 sont nommées doubles négatives CD4− CD8−. Les cellules exprimant CD4 et CD8 sont nommées doubles positives CD4 CD8[12] :
- pré-T où la chaîne lourde du TCR est présente à la surface de la cellule ;
- T immature où sont présentes la chaîne lourde et la chaîne légère du TCR avec les deux corécepteurs CD4 CD8 (double positif).
Le processus de sélection aboutit à des lymphocytes T matures.
La sélection négative détruit les cellules réagissant aux cellules du moi.
La sélection positive assure que le lymphocyte T reconnaît un peptide présenté par une cellule dendritique :
- si le lymphocyte T reconnaît avec une faible affinité un peptide présenté par un MHC de classe I avec un corécepteur CD8, le corécepteur CD4 va être détruit ;
- si le lymphocyte T reconnaît avec une faible affinité un peptide présenté par un MHC de classe II avec un corécepteur CD4, le corécepteur CD8 va être détruit ;
- si le lymphocyte T ne reconnaît aucun peptide présenté par un MHC de classe I ou II, le lymphocyte T va être détruit par apoptose.
Il faut souligner que cette sélection se fait avec les peptides du soi, c'est pourquoi la sélection se fait sur la faible attractivité.
Organes lymphoïdes
[modifier | modifier le code]Les organes lymphoïdes se divisent en organes lymphoïdes primaires et secondaires.
Organes lymphoïdes primaires
[modifier | modifier le code]Les organes lymphoïdes primaires comprennent la partie rouge de la moelle osseuse et le thymus. La moelle osseuse est le siège de l'hématopoïèse chez l'adulte et de la génération des lymphocytes B. Les lymphocytes se multiplient, se différencient et maturent dans le thymus. Dans la partie rouge de la moelle osseuse se trouvent les cellules souches hématopoïétiques ainsi que les souches des lymphocytes B et T.
Les cellules souches se différencient en lymphocytes B, se multiplient, produisent le récepteur BCR, subissent la sélection négative et rejoignent la circulation sanguine. Les cellules souches produisent aussi des progéniteurs des lymphocytes T qui vont se diriger immédiatement dans la circulation sanguine pour rejoindre le thymus où la maturation va se poursuivre.

Thymus
[modifier | modifier le code]Le thymus comprend deux zones : la zone corticale et la zone médullaire. Les progéniteurs des lymphocytes T prennent le nom de thymocytes quand ils pénètrent dans le thymus. Dans la zone corticale, le thymocyte est d'abord doublement négatif, ne produisant ni le CD4 ni le CD8, puis le TCR est produit par réarrangement successif de gène TCRTK et du gène TCR alpha et le thymocyte devient CD4 positif et CD8 négatif. La sélection positive TCR arrive ensuite, sélectionnant les thymocytes capables de reconnaître un MHC du soi. Les thymocytes qui reconnaissent avec une faible affinité les MHC classe I deviennent positifs TCD8. Les thymocytes qui reconnaissent avec une faible affinité les MHC classe II deviennent positifs TCD4. Ce processus s'accompagne d'un nombre très important de déchets correspondant aux thymocytes pour lesquels le TCR est incapable de reconnaître un MHC du soi : ceux-ci meurent par négligence en l'absence d'un signal de survie. Les thymocytes qui reconnaissent trop fortement un peptide sont également éliminés : c'est la sélection négative.
A la fin du processus de maturation, les thymocytes sont libérés dans la circulation sanguine et deviennent des lymphocytes T.
Organes lymphoïdes secondaires
[modifier | modifier le code]Les organes lymphoïdes secondaires sont les ganglions lymphatiques, la rate et les tissus lymphoïdes associés aux muqueuses.
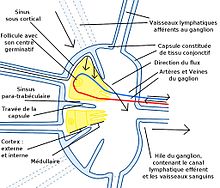
Le ganglion lymphatique
[modifier | modifier le code]Le ganglion lymphatique comporte trois zones : la zone corticale pour les lymphocytes B, la zone paracorticale pour les lymphocytes T et les cellules dendritiques et la zone médullaire où se trouvent les plasmocytes secrétant les immunoglobulines.
Le ganglion lymphatique bénéficie d'une double irrigation, une irrigation sanguine et une irrigation lymphatique par les vaisseaux lymphatiques. Cette irrigation lymphatique permet aux cellules dendritiques de voyager du lieu de l'infection vers le ganglion pour présenter l’antigène. Les lymphocytes B et T sont apportés par le sang. Ils migrent dans le stroma lymphatique au niveau des veinules à endothélium épais (High Epithelium Venules ou HEV) qui se trouvent principalement dans la zone corticale.
Les lymphocytes T et les cellules se trouvant dans la zone corticale, la présentation de l’antigène peut commencer.
Rate
[modifier | modifier le code]C'est la pulpe blanche de la rate qui est l’organe lymphoïde secondaire. La pulpe blanche entoure les artérioles terminales de l'artère splénique formant l'enveloppe lymphoïde péri artériolaire (Peri Arterial Lymphatique Sheaths) où se trouvent des lymphocytes B.
Tissus lymphoïdes associés aux muqueuses
[modifier | modifier le code]Première étape de la réponse immunitaire : reconnaissance et présentation de l'antigène
[modifier | modifier le code]Comment le système immunitaire peut-il reconnaître un agent pathogène alors que le répertoire des lymphocytes comporte des milliards de cellules B et T porteuses d'un récepteur antigénique adéquat capable de reconnaître un antigène pathogène venant de pénétrer dans l'organisme ? La réponse est que le système immunitaire a développé un mécanisme permettant de capter et de présenter l’antigène aux lymphocytes.
Cellule dendritique
[modifier | modifier le code]La cellule dendritique est la cellule du système immunitaire spécialisée dans la présentation d’antigène[13],[14]. Elle prépare l’antigène et le présente aux récepteurs d’antigène des lymphocytes T et B. Il existe plusieurs types cellulaires pouvant présenter l’antigène mais les cellules dendritiques sont les seules à pouvoir initier la réponse des lymphocytes T. Les cellules dendritiques sont présentes dans la peau, les muqueuses bronchiques, intestinales et de l'appareil urogénital. Elles sont aussi présentes dans les ganglions lymphatiques pour les pathogènes ayant réussi à échapper aux cellules dendritiques périphériques et dans la rate pour les pathogènes pénétrant directement dans le sang[12],[15].
La cellule dendritique existe sous deux formes : la forme immature et la forme mature.
Forme immature
[modifier | modifier le code]
La forme immature réside dans les tissus périphériques et la rate. Ces cellules ont une capacité élevée de captation d'un antigène. Elles portent plusieurs récepteurs à leur surface :
- des récepteurs des chimiokines de surface comme les récepteurs des chimiokines CCR1 et CCR2[16];
- des récepteurs endocytaires FcR (pour capter les immunoglobulines), des récepteurs du complément[16],[17] ;
- des récepteurs de détection d'information sur l’antigène comme les récepteurs de pattern[18],[19] et les récepteurs de cytokine[16],[20].
Forme mature
[modifier | modifier le code]La cellule dendritique devient mature lorsqu'elle capture l’antigène et migre dans le ganglion lymphatique[21]. Elle a une capacité élevée à présenter l’antigène et à activer des lymphocytes T mais elle perd sa capacité de captation de pathogènes (perte des FcR pour capter les immunoglobulines et des récepteurs du complément). Ses récepteurs de surface changent :
- les récepteurs des chimiokines (CCR7) qui lui permettent de quitter les tissus périphériques pour migrer dans les ganglions lymphatiques où les ligands pour les CCR7 sont présents en permanence[22],[23],[24] ;
- forte expression des MHC de classe II[25],[21],[26] ;
- forte expression des molécules d'adhésion[26],[21],[25] ;
- forte expression des molécules costimulatrices (CD40, CD80, CD86)[26],[21],[25].
La cellule dendritique, en plus de la fonction de présentation de l'antigène, a une fonction costimulatrice par les récepteurs de pattern.
Reconnaissance de l’antigène
[modifier | modifier le code]Les cellules B et les cellules T ne reconnaissent pas les antigènes (microbes) de la même façon :
- les cellules B reconnaissent les antigènes complets avec leurs récepteurs B. La cellule B peut donc reconnaître les antigènes présents dans le sang ;
- Les cellules T ne reconnaissent que de petites parties de l’antigène ou du peptide et le peptide doit être présenté aux cellules T par une molécule particulière, le composant majeur d'histocompatibilité (CMH ou MHC). L'antigène doit donc être préparé par la cellule dendritique puis présenté par celle-ci à la cellule T par l’intermédiaire du CMH.
Reconnaissance de l’antigène par les lymphocytes B
[modifier | modifier le code]Il existe deux modes de reconnaissance de l’antigène par les cellules B : le mode TD ou thymus-dépendant ou le mode TI ou thymus-indépendant. Le mode TD nécessite une cellule T porteuse du corécepteur CD4 (lymphocyte T helper; ou T CD4+)[27]. Le mode TI ne nécessite pas de T CD4+.
Mode thymus-dépendant ou TD
[modifier | modifier le code]
Le mode TD est l'activation de la cellule B par une cellule CD4+ ayant été activée par le même antigène : la plupart des antigènes activant le mode TD sont des protéines[27].
Le T CD4+ doit donc être stimulé par une cellule dendritique qui aura transmis un épitope (partie de l'antigène) de l'antigène au récepteur de la cellule T CD4+[27].
L’antigène entier se fixe sur le récepteur de la cellule B, déclenchant un premier signal[27].
Le T CD4+ va déclencher un deuxième signal en présentant l'épitope fixé sur son récepteur au CMH de type II du lymphocyte B. Cette présentation nécessite l'interaction du ligand CD40 du T CD4+ avec le CD40 de la cellule B[28],[27]
Le mode thymo-dépendant permet une réponse spécifique avec la production d'immunoglobulines G, A et E et la mémorisation de l'infection par le système immunitaire[27].
Mode thymus-indépendant ou TI
[modifier | modifier le code]Le mode TI est un mode qui ne nécessite pas de CD4+ et aboutit à la production d'immunoglobuline M durant quelques jours. Ce mode est un mode peu spécifique contre un pathogène et sans mémorisation. C'est un processus primitif de lutte contre l'infection[29].
Mode thymus-indépendant type 1
[modifier | modifier le code]Ce mode nécessite la stimulation simultanée des récepteurs de la cellule B et des récepteurs de pattern présent sur les cellules B[29].
Mode thymus-indépendant type 2
[modifier | modifier le code]Ce mode nécessite uniquement la stimulation simultanée des récepteurs de la cellule B. Les antigènes sont dans des grosses molécules présentant des épitopes répétés[29].
Reconnaissance de l’antigène par les lymphocytes T
[modifier | modifier le code]Le T CD4+ reconnaît des polypeptides de 10 à 30 acides aminés présentés par le MCH de classe II de la cellule dendritique. Le T CD8+ reconnaît des polypeptides de 8 à 10 acides aminés présentés par le MCH de classe I présent sur toutes les cellules du corps humain à l'exception des cellules anuclées (hématie, plaquette). Les peptides présentés par la cellule dendritique sont le résultat de la destruction du pathogène par la cellule dendritique.
Le mode de reconnaissance de l’antigène diffère selon qu'il s'agit d'une reconnaissance par une cellule T naïve ou par une cellule T à mémoire.
En immunologie, les cellules présentatrices de l’antigène (Antigen Processing Cell ou APC) sont les macrophages, la cellule dendritique et la cellule B. Ces trois cellules sont nommées APC professionnelles. Mais la cellule dendritique est la seule capable d'activer in vivo les cellules T naïves.
Cellule T naïve
[modifier | modifier le code]


La cellule T naïve nécessite la présentation d'un peptide par la cellule dendritique sur le MHC de type II et un cosignalisateur CD80/86 sur la cellule dendritique reconnu par un corécepteur CD28 de la cellule T.
Si la cellule présente le peptide à la cellule T sans activation par le corécepteur CD80/86, cela conduit à une inactivation de la cellule T appelée anergie. C'est une forme de tolérance car l'absence du corécepteur signale l'absence de danger. Cette tolérance est appelée tolérance périphérique si elle se situe dans les tissus périphériques ou tolérance centrale si elle se situe dans la moëlle osseuse ou le thymus.
Cellule T à mémoire
[modifier | modifier le code]La cellule T mémoire nécessite uniquement la présentation d'un peptide par la cellule dendritique sur le MHC de type II sans cosignalisateur.
Présentation de l’antigène
[modifier | modifier le code]La présentation de l'antigène se fait en deux étapes : la préparation de l’antigène et sa présentation.
Le MHC est la molécule principale de présentation de l'antigène, mais il existe d’autres molécules pouvant présenter des antigènes, notamment la molécule CD1, qui ne présente que des antigènes lipidiques et des glycolipides. Les cellules se fixant sur les CD1 sont certains TCD8, les lymphocytes NK et les lymphocytes T ayant des récepteurs gamma delta.
La préparation de l'antigène est le clivage de l’antigène en plusieurs peptides.
La présentation de l’antigène est la synthèse des molécules MHC par la cellule infectée, la capture des peptides viraux par le MHC et la migration du MHC à la surface de la cellule infectée ou de la cellule présentatrice d’antigène.
La MHC de classe I est formé d'une chaîne alpha et d'une microglobuline. La MHC de classe II est formé de deux chaînes alpha.
Synthèse des MHC : locus HLA
[modifier | modifier le code]La synthèse des MHC est sous la dépendance d'un locus 6p21,31 présent sur le chromosome 6 d’environ quatre millions de bases nommé locus HLA (Human Leucocyte Antigen). Il existe plus de 220 gènes identifiés sur ce locus dont 40 pour la synthèse des MHC.
Le locus HLA est divisé en 3 parties : les classes I, II et III. La partie HLA I code la chaîne alpha des MHC de classe I. La partie HLA II code les chaînes alpha et beta des MHC de classe II. La synthèse des MHC est codominante, c'est-à-dire que les deux allèles des gènes participent à la formation des MHC : l’allèle maternel et l'allèle paternel.
Les molécules MHC sont polymorphiques, contrairement aux autres protéines du corps humains. Ce polymorphisme explique pourquoi certains individus résistent mieux aux infections en ayant des MHC plus performants pour présenter des peptides viraux : ainsi les individus porteurs du locus HLA B 2757 résisteront mieux au virus du SIDA car ils ont une meilleure capacité à présenter les antigènes de ce virus.
Voies de présentation
[modifier | modifier le code]Il existe trois voies de présentation de l'antigène :
- la voie endogène ou voie du MHC I pour les antigènes cytosoliques pour présenter le peptide antigénique aux cellules T CD8+ ;
- la voie exogène ou voie du MHC II pour les antigènes extracellulaires et vacuolaires pour présenter le peptide antigénique aux cellules T CD4+ ;
- la voie croisée (cross pathway) spécifique aux cellules dendritiques, qui permet à celles-ci de produire des réponses T CD8+ contre des virus ou des cellules autres que les cellules dendritiques[30],[31],[32],[33].
Deuxième étape de la réponse immunitaire : réponse des lymphocytes T
[modifier | modifier le code]Les cellules du système immunitaire adaptatif sont les lymphocytes, dont les deux principaux types sont les lymphocytes T et les lymphocytes B. Le corps humain contient près de mille milliards de lymphocytes (10¹²) qui sont présents majoritairement dans le sang mais également dans la lymphe, les organes lymphoïdes et les tissus.
Chez l'adulte, les organes lymphoïdes secondaires contiennent des lymphocytes T et des lymphocytes B pouvant être dans au moins trois stades de différenciation :
- les lymphocytes naïfs sont des lymphocytes qui ont quitté la moelle osseuse ou le thymus, ont circulé dans les vaisseaux lymphatiques, mais n'ont pas encore rencontré leur antigène spécifique ;
- les lymphocytes effecteurs sont des lymphocytes qui ont été activés par leur antigène spécifique et qui sont encore dans le processus d'élimination du pathogène ;
- les lymphocytes mémoire sont des lymphocytes activés au cours d'infections antérieures et pouvant être réactivés.
Les cellules T sont au cœur de la réponse immunitaire adaptative. Les cellules T assurent trois fonctions dans la lutte contre les infections :
- elles détruisent le pathogène intracellulaire par une action directe des lymphocytes cytotoxiques T CD8+ ;
- elles déclenchent la production d'anticorps des lymphocytes B en déclenchant un deuxième signal de danger par les lymphocytes helpers T CD4+ ;
- elles stimulent la destruction des germes intracellulaires par les lymphocytes helpers T CD4+.
Les lymphocytes T auxiliaires, ou lymphocytes T CD4, jouent un rôle important dans l'établissement et le maintien de la réponse immunitaire adaptative. Ces cellules n'ont ni capacité cytotoxique ni capacité de phagocytose et ne peuvent pas directement tuer des cellules cibles ou éliminer des agents infectieux, mais elles jouent un rôle essentiel dans l'orchestration de la réponse immunitaire. Les lymphocytes T auxiliaires possèdent un récepteur antigénique qui reconnaît des peptides présentés par le CMH de classe II exprimé par les cellules présentatrices d'antigène professionnelles. Les lymphocytes T auxiliaires activés relarguent des cytokines qui influencent l'activité de nombreux types cellulaires, y compris les cellules présentatrices d'antigène. Les lymphocytes T auxiliaires peuvent activer d'autres cellules comme les lymphocytes T cytotoxiques ou les lymphocytes B.
Activation du lymphocyte T
[modifier | modifier le code]L'activation du lymphocyte T se fait par la formation de la synapse immunologique entraînant l'activation avec une phase de prolifération nommée expansion clonale par l'action de l'interleukine 2. La prolifération s'accompagne d'une différenciation en lymphocytes cytotoxiques T CD8 et en cellules T à mémoire.

Activation des cellules par les cellules présentatrices de l’antigène : synapse immunologique
[modifier | modifier le code]Activation du T CD4
[modifier | modifier le code]L'activation des cellules T nécessite deux évènements : la reconnaissance de l’antigène par le récepteur de la cellule T (TCR) et une costimulation. Le contact initial entre la cellule dendritique et la cellule T se produit avec des molécules d'adhésion cellulaire. Après la reconnaissance du peptide montré par le MHC de classe II par le récepteur du lymphocyte T, un corécepteur va se former. La synapse immunologique comprend :
- le complexe MHC-peptide/ TCR ;
- les corécepteurs CD4/CD8 ;
- les molécules costimulatrices assurant le deuxième signal ;
- des molécules d’adhésion cellulaire permettant au lymphocyte T de rester un temps suffisant collé avec la cellule dendritique pour atteindre une force de signal suffisante permettant son activation.
Superantigène
[modifier | modifier le code]Un superantigène est une protéine virale qui se fixe simultanément sur le récepteur du lymphocyte T et sur le récepteur MHC, entraînant une libération brutale et massive de cytokines et une expansion clonale de cellules T incompétentes.
Molécules costimulatrices
[modifier | modifier le code]Il existe deux classes de molécules costimulatrices :
- la classe CD80/CD86 parfois nommée B7-1/B7-2 qui interagissent avec CD28 ou CTLA4 présent sur les cellules T en réduisant la force du signal nécessaire pour activer la cellule T ;
- la classe CD40/CD40 ligand, appartenant à la famille des récepteurs au facteur de nécrose tumorale :
- la classe CD40L est sur les cellules T et détermine la force de réponse des cellules T,
- la classe CD 40, présente sur les cellules présentatrices d’antigène, assure un mécanisme de régulation sur les CD80/CD86 et intervient dans la libération de l'interleukine-12.
En l'absence de costimulation, la cellule T n'a pas d'expansion clonale. La cellule T est incapable de lutter contre l'infection. La costimulation est un mécanisme qui assure que la cellule T ne s'active que pour des pathogènes.
Molécules d'adhésion
[modifier | modifier le code]Les molécules d'adhésion permettent à la cellule dendritique de rester suffisamment longtemps pour transmettre les signaux de reconnaissance de peptide et de danger au lymphocyte T. Les molécules d'adhésion se trouvent sur les cellules T avec les ligands sur la cellule dendritique.
Les molécules d'adhésion appartiennent à la famille des protéines hétérodimériques nommée intégrine, par exemple la protéine LFA-1 (Leucocyte Function Associated Antigen 1) qui se fixe avec une protéine ICAM 1 (Intracellular Adhesion Molecule 1) de la cellule dendritique.
Activation du T CD8
[modifier | modifier le code]L'activation du T CD8 par une infection peut se faire de deux façons : soit la cellule dendritique est elle-même infectée (par un virus par exemple) ; dans ce cas la cellule dendritique va stimuler directement le T CD8 en lui présentant les peptides viraux via les MHC de type II aux récepteurs des cellules T CD8 naïves, ceux-ci se transformant en lymphocyte killer. Donc, une activation des T CD8 en lymphocyte killer est possible sans intervention des T CD4
Soit la cellule dendritique va phagocyter une cellule quelconque infectée par le virus, présenter le peptide viral aux cellules T CD4 et aussi aux cellules T CD8. L'activation du T CD8 va nécessiter l'augmentation de l'activité des costimulateurs CD40/CD40L et la libération de cytokines.
Le récepteur CD40 est présent dans les cellules B, les macrophages et les cellules dendritiques.
Conséquence de l'activation des cellules T
[modifier | modifier le code]Les voies de signalisation
[modifier | modifier le code]Le complexe MHC-peptide/ TCR et les corécepteurs CD4/CD8 vont déclencher la voie de signalisation aussi nommée voie de transduction. En biologie cellulaire, on appelle ainsi les cascades de protéines déclenchées par un récepteur de surface qui vont modifier le propriétés de la cellule le plus souvent à travers l'expression des gènes :
- prolifération des cellules par la voie de transcription des kinases ;
- différenciation des cellules T par la voie de transcription NFAT et NfkB ;
- mobilité des cellules T par la voie de transcription Rho/CDC42.
Production de cytokines
[modifier | modifier le code]Expansion clonale
[modifier | modifier le code]Les cellules T sont au repos dans le thymus. L'activation par la cellule dendritique va réveiller la cellule T qui va se multiplier en produisant un ensemble de cellules rigoureusement identiques et spécifiques pour attaquer le pathogène incriminé. La molécule responsable de l'activation et de la prolifération des cellules T est la cytokine interleukine-2. L' interleukine-2 va agir par voie autocrine (sur la cellule qui la produit) ou par voie paracrine (sur les cellules proches d 'elle). Les traitements immunosuppresseurs utilisés dans les greffes d'organes agissent en perturbant le fonctionnement de l'interleukine-2. L'amplitude de la réponse diffère selon le type de cellule T. Le nombre de cellules T CD8 va être multiplié par 100 000, le nombre de cellules T CD4 va être multiplié par un facteur compris entre 100 et 1000. La division lymphocytaire est un processus long: la division d'une cellule lymphocytaire dure 6 heures environ. Enfin, un clone cellulaire est spécifique pour un petit nombre de peptides immunodominants de l'agent infectieux.
Différenciations des cellules T
[modifier | modifier le code]La réponse Th1 est caractérisée par la production d'interféron γ qui active l'activité bactéricide des macrophages et induit la production d'immunoglobulines IgG par les lymphocytes B. La réponse Th1 permet notamment une réponse efficace contre les bactéries intracellulaires et les virus. La réponse Th2 est caractérisée par la production d'interleukine 4, qui induit la production d'immunoglobulines IgE par les lymphocytes B. La réponse Th17 est caractérisée par la production d'interleukine-17 qui induit le recrutement de neutrophiles. La réponse Th17 permet notamment une réponse efficace contre les bactéries extracellulaires et les levures comme Candida albicans.
Il existe d'autres sous-populations de lymphocytes T effecteurs, comme les lymphocytes Th9 caractérisés par la production d'interleukine 9 ou les lymphocytes Th22 caractérisés par la production d'interleukine-22 ou les lymphocytes T folliculaires. Les lymphocytes T régulateurs peuvent être préprogrammés ou être inductibles en périphérie comme les populations décrites ci-dessus et jouent un rôle important dans la régulation des réponses immunitaires.
Comme pour les lymphocytes T cytotoxiques, une partie des lymphocytes T auxiliaires sont conservés après l'élimination d'un agent infectieux et constituent une population de lymphocytes T mémoire.
Le virus de l'immunodéficience humaine infecte et élimine progressivement les lymphocytes T auxiliaires, ce qui a pour effet de compromettre l'efficacité de la réponse immunitaire contre les virus mais également contre d'autres classes de microorganismes et conduit au syndrome d'immunodéficience acquise.
Différenciations des cellules T CD4
[modifier | modifier le code]À côté de la fonction d'activation de la cellule T CD8 en T Killer et de la fonction de stimulation de la cellule B indispensable pour la sécrétion d’antigène, la cellule B CD4 peut se différencier en cellule directement active en exprimant des molécules de surface et des cytokines différentes. Un des récepteurs de la cellule B activée est le ligand CL40L, Ce ligand CD40 L peut se fixer sur les macrophages au récepteur CD40. Le système immunitaire répond de façon différente à des pathogènes différents comme les virus, les parasites, les bactéries, les helminthes ou les champignons.
Par exemple, comme les helminthes sont trop gros pour être phagocytés, la réponse immunitaire à une infection par helminthes est dominée par la sécrétion d'immunoglobulines de type E et l'activation des éosinophiles. Pour un microbe intracellulaire comme celui de la tuberculose, qui résiste à la destruction intracellulaire, le système adaptatif consiste à activer les phagocytes par les T CD4 pour tuer les cellules infectées.
Cette réponse fait appel aux T CD4. En créant des T CD4 spécialisés, le système immunitaire peut répondre à différents types d'infection. Cette spécialisation est nommée la polarisation des cellules T.

T CD4 Th1 et T CD4 Th2
[modifier | modifier le code]Les groupes les mieux étudiés sont les groupes spécialisés pour les infections intracellulaires (virus, mycobactérie, listéria) de type Th 1 et le groupe pour les infections des vers parasites.
Tableau des cytokines impliquées dans le développement des CD4 Th1 et CD4.
Cette différenciation se fait principalement par le type de cytokine produite.
Cellules Th1
[modifier | modifier le code]Les cellules Th1 produisent l'interféron gamma et l'interleukine-12 qui permet après activation du facteur de transcription T-Bet de :
- Activer des phagocytes à tuer les microbes ingérés
- Stimuler la production de certains types (isotypes) d'anticorps qui favorisent la phagocytose et l'opsonisation des microbes
- Stimuler l'expression des molécules MHC de classe II et des costimulateurs CD80/CD86 sur les macrophages et les cellules dendritiques
- Induire la prolifération des lymphoctyes killer
Cellules Th2
[modifier | modifier le code]La réponse Th2 permet notamment une réponse efficace contre les parasites[34]; Les réactions allergiques sont des réactions de type Th2
Les cellules Th2 produisent l'interleukine-4, l'interleukine-5, l'interleukine-13 qui stimule, après activation du facteur de transcription GATA-3:
- La production d'immunoglobulines E qui active les éosinophiles. L'immunoglobuline E active les mastocytes et se fixe aux éosinophiles (IL-4 et IL-5)
- L'expulsion des parasites des muqueuses et l'inhibition de l'entrée des microbes en stimulant la production de mucus
Différenciations des cellules T CD8
[modifier | modifier le code]Réponse effectrice des cellules T
[modifier | modifier le code]Certaines populations de lymphocytes T auxiliaires ont une fonction prédéterminée, comme les lymphocytes T régulateurs qui se développent dans le thymus, alors que d'autres populations ont des fonctions inductibles. Au cours d'une infection, les cellules présentatrices d'antigène professionnelles détectent des signaux microbiens caractéristiques de l'agent infectieux. En fonction de ces signaux, les cellules présentatrices d'antigène peuvent produire différentes cytokines et exprimer différentes protéines à leur surface. Lorsque ces cellules interagissent avec les lymphocytes T auxiliaires naïfs dans les ganglions lymphatiques, différents programmes de différenciation sont induits en fonction des cytokines produites. Ainsi, des lymphocytes T ayant une spécificité donnée peuvent exercer des effets différents en fonction des signaux perçus par les cellules présentatrices d'antigène.
Caractéristiques générales
[modifier | modifier le code]Les cellules effectrices augmentent l'expression des molécules d’adhésion à leur surface afin de favoriser et d'étendre le contact avec les cellules présentatrices d'antigènes pour les CD4 et avec les cellules cibles dans le cas des lymphocytes cytotoxiques CD8+. Les cellules effectrices modifient les récepteurs aux chimiokines nommés aussi récepteurs d’adressage qui permettent aux cellules T de quitter les ganglions lymphatiques et de migrer vers les sites d'infection (récepteur CCR5 et CXCR3). Le récepteur CCR5 est utilisé par le virus VIH pour pénétrer dans les lymphocytes. Une autre caractéristique des cellules T effectrices est la production de cytokines (IL-4) et d'enzymes (perforine et granzyme).
En résumé, une cellule T effectrice produira des cytokines, des récepteurs de chimiokines, des protéines d'adhésion et des molécules spécifiques pouvant agir sur les cellules cibles.
Réponse effectrice des cellules T CD4
[modifier | modifier le code]Rôle des cellules Th1
[modifier | modifier le code]Activation du macrophage
[modifier | modifier le code]L'activation du macrophage nécessite l'action des lymphocytes T CD4+ Th1 par la production d'interférons gamma et l’interaction CD40:CD40L. Le macrophage va présenter les peptides, grâce à son MHC, aux récepteurs du T CD4+ qui vont reconnaître ce peptide comme étant le même peptide présenté par la cellule dendritique alors que le T CD4 était naïf. Le macrophage va produire des réactifs oxygénés et nitrogénés, des enzymes lysosomales qui rendent le macrophage beaucoup plus agressif. La réaction du macrophage est proinflammatoire avec risque d'endommager les tissus cellulaires. Le macrophage va à son tour libérer du TNF, de l' IL-1 et IL-12 et chemokines. L'IL-12 va par un rétrocontrôle positif stimuler le Th1.
Rôle des cellules Th2
[modifier | modifier le code]Les actions des cellules Th2 se font grâce à la sécrétion des interleukines 4 et des interleukines 5.
Rôle des cellules Th17
[modifier | modifier le code]Rôle des cellules Treg
[modifier | modifier le code]Les cellules Treg sont des cellules qui expriment le récepteur Foxp3. Elles sont générées soit dans le tissu, soit dans les organes lymphoïdes secondaires.
Elles participent à la tolérance périphérique en inhibant les réponses des cellules T par inhibition de l'interleukine 12.
Réponse effectrice des cellules T CD8 : lymphocytes T cytotoxiques
[modifier | modifier le code]Les lymphocytes T cytotoxiques sont un sous-groupe de lymphocytes T qui sont capables d'induire la mort par apoptose des cellules infectées par des virus (ou par d'autres agents infectieux) ou des cellules cancéreuses.
Les lymphocytes T cytotoxiques naïfs sont activés lorsque leur récepteur antigénique reconnaît un complexe peptide-CMH de classe I présenté à la surface d'une cellule cible. L'interaction de haute affinité permet au lymphocyte T cytotoxique de rester en contact avec la cellule cible. Une fois activés, les lymphocytes T cytotoxiques prolifèrent. Ce processus, appelé expansion clonale, aboutit à un clone de cellules ayant une même affinité ce qui amplifie la réponse immunitaire spécifique de l'antigène reconnu. Les lymphocytes T cytotoxiques activés recirculent ensuite dans l'organisme afin de contrôler les cellules présentant le même antigène que celui pour lequel ils sont spécifiques.
Lorsqu'ils reconnaissent une cellule infectée ou une cellule cancéreuse, les lymphocytes T cytotoxiques relarguent des perforines qui induisent la formation de pores dans la membrane plasmique des cellules cibles, ce qui conduit à l'entrée d'ions et d'eau dans les cellules cibles et conduit à leur lyse. Les lymphocytes T cytotoxiques relarguent également des granzymes qui entrent dans les cellules à travers les pores et induisent la mort des cellules par apoptose. Afin d'éviter une dégradation tissulaire trop importante, l'activation des lymphocytes T cytotoxiques nécessite à la fois une interaction forte entre le récepteur antigénique et le complexe CMH-antigène de la cellule cible et l'interaction avec des lymphocytes T auxiliaires.
Une fois que l'infection est endiguée, la plupart des lymphocytes T cytotoxiques meurent par apoptose et sont éliminés par les phagocytes mais un petit nombre de lymphocytes deviennent des lymphocytes T cytotoxiques mémoire. Au cours d'une infection ultérieure par un même agent infectieux, ces lymphocytes T cytotoxiques mémoire prolifèrent plus rapidement et permettent donc une réponse immunitaire plus efficace.
Troisième étape de la réponse immunitaire : réponse des lymphocytes B
[modifier | modifier le code]La réponse des lymphocytes B est la réponse humorale, c'est-à-dire la réponse du système immunitaire permettant à l'organisme de se défendre contre des microbes qui sont à l'extérieur des cellules et aussi contre les toxines sécrétées par ces microbes. Les cellules B reconnaissent les microbes par leur récepteur (BCR) qui sont des immunoglobulines fixées sur la membrane des cellules B ou immunoglobulines membranaires. La stimulation des immunoglobulines membranaires par un antigène microbien va entraîner une modification de la cellule B en plasmocyte et ces plasmocytes vont sécréter les immunoglobulines dans le sang: ces immunoglobulines sont appelées immunoglobulines solubles ou anticorps. Les plasmocytes peuvent sécréter entre 500 et 1 000 anticorps par seconde qui sont capables d'agir à distance.
Les cellules B sont formées dans la partie rouge de la moëlle osseuse et une sélection négative élimine les cellules B réagissant aux protéines de l'organisme, c'est-à-dire possédant des immunoglobulines membranaires M autoréactives.
Les cellules B sont alors secrétées dans le sang par lequel elles rejoignent les ganglions lymphatiques ou la rate. Ce sont des cellules B naïves car elles n'ont jamais été en contact avec un antigène. Les cellules B naïves ne possèdent que des immunoglobulines membranaires de type M ou D. La formation des immunoglobulines D membranaires se fait par épissage.
Dans le ganglion lymphatique, les cellules B rejoignent les follicules ganglionnaires ou la rate.
L'activation des cellules B nécessite deux signaux comme pour les cellules T :
- le premier signal est déclenché par des antigènes microbiens à valence élevée comme des polysaccharides, des lipopolysaccharides, des polysaccharides ou des capsides virales.
- le deuxième signal peut être apporté par l’antigène lui-même ou par interaction avec une cellule T CD4+.
Il existe plusieurs types de cellules B :
- les cellules B folliculaires (B2) type principal des cellules B dans les follicules ganglionnaires ou de la rate ;
- les cellules B de la zone marginale localisées dans les zones périphériques de la pulpe blanche splénique ;
- les cellules B-1 présentes dans les muqueuses répondant aux antigènes non protéiques.
Réponse B aux antigènes T-indépendante
[modifier | modifier le code]La réponse B aux antigènes T-indépendante est la réponse des cellules B qui ne nécessitent pas l'intervention d'un lymphocyte T CD4+ (lymphocyte auxiliaire). Les cellules B de la zone marginale et les cellules B-1 présentes dans les muqueuses contribuent aux réponses cellule T-indépendante. La réponse est une sécrétion d'immunoglobuline M non spécifique, de courte durée et ne produisant pas de cellule mémoire.
Réponse B thymus-indépendant de type 1
[modifier | modifier le code]Antigène qui engage le récepteur cellulaire B pour le premier signal et un récepteur de pattern pour le second signal.
Réponse B thymus-indépendant de type 2
[modifier | modifier le code]Antigène qui engage uniquement le récepteur cellulaire B pour le premier signal et pour le second signal. Cette réponse B thymus-indépendante est la source continue d'anticorps naturels produits par le corps humain en réponse aux antigènes de la flore intestinale.
Réponse B aux antigènes T-dépendante
[modifier | modifier le code]Les lymphocytes B sont les cellules produisant les anticorps, qui circulent dans le sang et la lymphe, et sont donc responsables de l'immunité à médiation humorale. Les anticorps, ou immunoglobulines (Ig), sont des protéines permettant la reconnaissance et la neutralisation de corps étrangers comme les agents infectieux ou les toxines. Chez les mammifères, il existe différents isotypes d'immunoglobulines : les IgA, IgG, IgE, IgD et IgM, dont les propriétés sont différentes. Comme les lymphocytes T, les lymphocytes B ont un récepteur antigénique à leur surface. Toutefois la nature de ce récepteur est différente de celui des lymphocytes T puisqu'il s'agit d'un anticorps fixé à la surface de la cellule et non d'un récepteur pouvant reconnaître un complexe peptide-CMH. L'une des différences entre les lymphocytes T et les lymphocytes B est que les lymphocytes T reconnaissent un antigène présenté par le CMH à la surface d'une cellule alors que les lymphocytes B reconnaissent un antigène dans sa forme native. Lorsqu'un lymphocyte B reconnaît un antigène spécifique et qu'il est activé par un lymphocyte T auxiliaire, il se différencie en plasmocyte. Les plasmocytes sont des cellules dont la durée de vie est de quelques jours et qui sécrètent des anticorps. Ces anticorps peuvent se fixer aux microorganismes, et fournissent ainsi des repères aux cellules phagocytes et au système du complément. Près de 10 % des plasmocytes survivent à l'issue d'une infection et deviennent des lymphocytes B mémoire à longue durée de vie. Au cours d'une infection ultérieure par un même microorganisme, ces cellules produisent des anticorps plus rapidement et leur efficacité est plus importante.
Reconnaissance
[modifier | modifier le code]Les cellules B reconnaissent directement l'antigène par le complexe du récepteur des cellules B (BCR) dans l'organe lymphoïde secondaire (rate ou ganglion). Ces antigènes sont:
- soit transportés par les cellules dendritiques ou des macrophages
- soit apportés par simple diffusion dans le sang ou la lymphe
La reconnaissance de l’antigène par le BCR assure deux fonctions :
- activation des voies de signalisation
- internaliser l'antigène pour permettre à une MCH (classe 2) de le présenter à un lymphocyte T CD4+
Le BCR est formé d'une immunoglobuline membranaire de type D ou M et d'un co récepteur (CD79) qui est hétérodimére de deux polypeptides (Ig alpha et Ig beta). Ce sont des corécepteurs transmembranaires de type 1 de la super famille des immunoglobulines qui possèdent des motifs ITAM.
Activation
[modifier | modifier le code]L'activation de la cellule B nécessite deux signaux.
Premier signal : activation par le microbe sur le récepteur de la cellule B
[modifier | modifier le code]Le premier signal nécessite la reconnaissance du microbe par le complexe BCR et les corécepteurs activateurs CD21/CD2 qui fixent le complément C3d lui même fixé sur le microbe. Le complément C3d appartient au système immunitaire inné. Cet ensemble permet l'activation par des mécanismes de transcription dont il existe trois voies principales nommées par une des enzymes participant à la transcription (la voie NfkappaB, la voie NF-AT, la voie MAP kinase).
La reconnaissance de microbe par le complexe BCR va entraîner :
- la synthèse de récepteurs de cytokines à la surface de la cellule B
- l’expression des molécules costimulatrices (CD80/CD86)
- la synthèse de molécules d’adhésion pour favoriser l'interaction avec le CD4+ auxiliaire
- l'internalisation de l'antigène, c'est-à-dire la reconnaissance de peptides du microbe dotés d'un fort pouvoir antigénique, la synthèse de MHC de classe II et la présentation du peptide par ce MHC.
Deuxième signal : activation par le lymphocyte T auxiliaire CD4+
[modifier | modifier le code]Le deuxième signal implique le lymphocyte T auxiliaire CD4+ qui aura avant était sensibilisé aux mêmes épitopes présentés par une cellule dendritique. Le deuxième signal va être déclenché par la formation de la synapse immunologique décrit précédemment puis la libération de cytokine.
Conséquences
[modifier | modifier le code]Les conséquences de l'activation de la cellule B lymphocytaire sont :
- l'expansion clonale
- la différenciation extrafolliculaire des lymphocytes B en plasmocytes avec production d'immunoglobulines M non spécifiques et de courte durée de vie
- la différenciation folliculaire des lymphocytes B en plasmocytes dans un centre germinatif avec production d'immunoglobulines G, A et E de forte spécificité et forte affinité.

Différenciation
[modifier | modifier le code]Trois évènements majeurs se déroulent dans le centre germinatif :
- l'hypermutation somatique (SMH) dans la zone sombre. Ce processus introduit des mutations ponctuelles dans la région v des immunoglobulines entraînant la production de cellule B d'affinité et de spécificité nouvelle
- la recombinaison de commutation de classe (CSR) dans la zone sombre. Ce processus change la classe de la chaîne lourde de l'immunoglobuline. Celle-ci passe de la classe M à la classe G, E ou A
- la sélection des cellules B dans la zone claire sélectionne les cellules B les plus performantes contre le microbe et détruit les cellules B pouvant attaquer l'organisme de la personne.
L'hypermutation somatique
[modifier | modifier le code]L'hypermutation somatique ou mutation d'affinité est le changement de quelques acides aminés dans la partie variable de l'immunoglobuline membranaire du complexe récepteur. Ce changement intéresse autant la chaîne lourde que la chaîne légère. Comme une division de lymphocyte dure 6 heures, au bout d'une semaine, une cellule B produit environ 5000 lymphocytes B. Ce processus est encore mal connu, mais dépend de l'enzyme désaminase activation dépendante. Le but de ce processus est de produire des immunoglobulines de plus en plus efficaces contre un microbe. Durant ce processus interviennet des mécanismes de sélection positive pour empêcher l'apparition d'anticorps attaquant l'organisme.
La recombinaison de commutation de classe
[modifier | modifier le code]La recombinaison de commutation de classe (class switch recombination, CSR) permet aux cellules B de changer leur isotype d'immunoglobuline M en d'autres isotypes sans pour autant modifier leur spécificité de fixation d'antigène. La CSR est une réaction de recombinaison-délétion au niveau de l'ADN. La commutation de classe est régulée par des cytokines qui ouvrent la chromatine des deux régions participantes. Les cytokines induisent les anticorps les mieux adaptés pour combattre l'infection.
| Cytokine sécrétée par le T CD4 | Anticorps sécrété par la cellule B |
|---|---|
| Interleukine 4 | Immunoglobuline E |
| Interleukine 13 | Immunoglobuline G4 |
| Interleukine 10 | Immunoglobuline G1 et G3 |
| interféron gamma | Immunoglobuline G2 |
| Interleukine 10 + TGF beta | Immunoglobuline A |
La sélection des cellules B
[modifier | modifier le code]Mémoire immunitaire
[modifier | modifier le code]À l'issue d'un épisode infectieux, une partie des lymphocytes B et T qui ont été activés deviennent des lymphocytes mémoire. Lors d'une infection par le même agent infectieux, ces cellules agissent plus rapidement et plus efficacement que lors de la première infection par cet agent infectieux. C'est l'une des raisons pour lesquelles on parle d'immunité « adaptative », en cela que l'organisme s'adapte à son environnement en se préparant à des infections répétées par un même microorganisme. La mémoire immunitaire peut s'acquérir de façon passive ou de façon active.
Mémoire immunitaire acquise passivement
[modifier | modifier le code]La mémoire immunitaire acquise passivement peut durer entre plusieurs jours et plusieurs mois. Les nouveau-nés n'ayant pas été confrontés à des agents infectieux, et n'ayant donc pas eu l'occasion de se constituer un pool de cellules mémoire, sont particulièrement vulnérables aux infections. Plusieurs mécanismes de mémoire immunitaire passive leur sont transmis par la mère durant la vie fœtale. Les IgG maternelles sont transportées à travers le placenta et permettent ainsi aux nouveau-nés d'avoir un répertoire d'IgG circulantes dont la spécificité et l'efficacité correspondent à une réponse mémoire de la mère. Le lait maternel contient également des anticorps permettant de protéger les nouveau-nés contre les infections intestinales.
Mémoire immunitaire acquise activement
[modifier | modifier le code]La mémoire immunitaire peut s'acquérir naturellement au cours d'une infection ou artificiellement par la vaccination. Les maladies infectieuses ont toujours été, et sont toujours, une cause majeure de mortalité dans la population humaine. Durant les derniers siècles, deux principes essentiels ont permis de réduire la mortalité liée aux infections : l'hygiène et la vaccination. La vaccination est l'induction délibérée d'une réponse immunitaire et représente le moyen le plus efficace de prévenir une infection en agissant sur les mécanismes naturels de mise en place d'une réponse immunitaire mémoire. Le principe sous-jacent à la vaccination est d'administrer dans l'organisme un agent infectieux dont le potentiel pathogène est au préalable atténué pour éviter l'infection, mais suffisant pour induire l'immunisation et la mise en place d'une réponse mémoire. La vaccination peut également s'effectuer par administration d'antigènes dérivés d'organismes infectieux, et s'accompagne généralement de l'injection d'adjuvants permettant d'induire une réponse immunitaire suffisamment forte.
Résistance des agents pathogènes face aux lymphocytes
[modifier | modifier le code]Notes et références
[modifier | modifier le code]- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Adaptive immune system » (voir la liste des auteurs).
- (en) Martin F. Flajnik & Masanori Kasahara, « Origin and evolution of the adaptive immune system: genetic events and selective pressures », Nature Reviews Genetics, vol. 11, no 1, , p. 47–59 (DOI 10.1038/nrg2703)
- (en) Medzhitov R, Recognition of microorganisms and activation of the immune response, Nature 449, 819-826 (18 octobre 2007)
- Article paru dans le no 349 du magazine La Recherche (janvier 2002)
- (en) Bruce D. Wines et P. Mark Hogarth, « IgA receptors in health and disease », Tissue Antigens, vol. 68, no 2, , p. 103–114 (ISSN 0001-2815 et 1399-0039, DOI 10.1111/j.1399-0039.2006.00613.x, lire en ligne, consulté le )
- (en) Bebhinn Treanor, « B-cell receptor: from resting state to activate », Immunology, vol. 136, no 1, , p. 21–27 (ISSN 1365-2567, PMID 22269039, PMCID PMC3372753, DOI 10.1111/j.1365-2567.2012.03564.x, lire en ligne, consulté le )
- (en) Michael Reth, « Antigen receptor tail clue », Nature, vol. 338, no 6214, , p. 383–384 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/338383b0, lire en ligne, consulté le )
- (en) Joachim Hombach, Takeshi Tsubata, Lise Leclercq et Heike Stappert, « Molecular components of the B-cell antigen receptor complex of the IgM class », Nature, vol. 343, no 6260, , p. 760–762 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/343760a0, lire en ligne, consulté le )
- (en) Wolfgang W.A Schamel et Michael Reth, « Monomeric and Oligomeric Complexes of the B Cell Antigen Receptor », Immunity, vol. 13, no 1, , p. 5–14 (DOI 10.1016/S1074-7613(00)00003-0, lire en ligne, consulté le )
- (en) Matthew E. Call, Jason Pyrdol, Martin Wiedmann et Kai W. Wucherpfennig, « The Organizing Principle in the Formation of the T Cell Receptor-CD3 Complex », Cell, vol. 111, no 7, , p. 967–979 (DOI 10.1016/S0092-8674(02)01194-7, lire en ligne, consulté le )
- (en) De Dong, Lvqin Zheng, Jianquan Lin et Bailing Zhang, « Structural basis of assembly of the human T cell receptor–CD3 complex », Nature, vol. 573, no 7775, , p. 546–552 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/s41586-019-1537-0, lire en ligne, consulté le )
- (en) Peter Mombaerts, John Iacomini, Randall S. Johnson et Karl Herrup, « RAG-1-deficient mice have no mature B and T lymphocytes », Cell, vol. 68, no 5, , p. 869–877 (DOI 10.1016/0092-8674(92)90030-G, lire en ligne, consulté le )
- Neefjes J, Jongsma ML, Paul P, Bakke O. Towards a systems understanding of MHC class I and MHC class II antigen presentation. Nat Rev Immunol. 2011 Nov 11;11(12):823-36. doi: 10.1038/nri3084.
- (en) R. M. Steinman et M. D. Witmer, « Lymphoid dendritic cells are potent stimulators of the primary mixed leukocyte reaction in mice », Proceedings of the National Academy of Sciences, vol. 75, no 10, , p. 5132–5136 (ISSN 0027-8424 et 1091-6490, PMID 154105, PMCID PMC336278, DOI 10.1073/pnas.75.10.5132, lire en ligne, consulté le )
- Jacques Banchereau, Francine Briere, Christophe Caux et Jean Davoust, « Immunobiology of Dendritic Cells », Annual Review of Immunology, vol. 18, no 1, , p. 767–811 (ISSN 0732-0582, DOI 10.1146/annurev.immunol.18.1.767, lire en ligne, consulté le )
- Trombetta ES, Mellman I. « Cell biology of antigen processing in vitro and in vivo. » Annu Rev Immunol. 2005;23:975-1028.
- (en) Silvia Cerboni, Matteo Gentili et Nicolas Manel, « Chapter Eight - Diversity of Pathogen Sensors in Dendritic Cells », dans Advances in Immunology, vol. 120, Academic Press, coll. « Development and Function of Myeloid Subsets », (lire en ligne), p. 211–237
- Maria Rescigno, Francesca Granucci et Paola Ricciardi-Castagnoli, « [No title found] », Journal of Clinical Immunology, vol. 20, no 3, , p. 161–166 (DOI 10.1023/A:1006629328178, lire en ligne, consulté le )
- (en) Marta Muzio, Daniela Bosisio, Nadia Polentarutti et Giovanna D’amico, « Differential Expression and Regulation of Toll-Like Receptors (TLR) in Human Leukocytes: Selective Expression of TLR3 in Dendritic Cells », The Journal of Immunology, vol. 164, no 11, , p. 5998–6004 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.164.11.5998, lire en ligne, consulté le )
- (en) Ruslan Medzhitov, Paula Preston-Hurlburt et Charles A. Janeway, « A human homologue of the Drosophila Toll protein signals activation of adaptive immunity », Nature, vol. 388, no 6640, , p. 394–397 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/41131, lire en ligne, consulté le )
- (en) R. Keller, R. Gehri et R. Keist, « Macrophage Response to Viruses, Protozoa, and Fungi: Secretory and Cellular Activities Induced in Resting Unprimed Bone Marrow-Derived Mononuclear Phagocytes », Cellular Immunology, vol. 159, no 2, , p. 323–330 (DOI 10.1006/cimm.1994.1318, lire en ligne, consulté le )
- (en) E. Sergio Trombetta et Ira Mellman, « CELL BIOLOGY OF ANTIGEN PROCESSING IN VITRO AND IN VIVO », Annual Review of Immunology, vol. 23, no 1, , p. 975–1028 (ISSN 0732-0582 et 1545-3278, DOI 10.1146/annurev.immunol.22.012703.104538, lire en ligne, consulté le )
- (en) Lars Ohl, Mariette Mohaupt, Niklas Czeloth et Gabriele Hintzen, « CCR7 Governs Skin Dendritic Cell Migration under Inflammatory and Steady-State Conditions », Immunity, vol. 21, no 2, , p. 279–288 (DOI 10.1016/j.immuni.2004.06.014, lire en ligne, consulté le )
- (en) Federica Sallusto, Patrick Schaerli, Pius Loetscher et Christoph Schaniel, « Rapid and coordinated switch in chemokine receptor expression during dendritic cell maturation », European Journal of Immunology, vol. 28, no 9, , p. 2760–2769 (ISSN 1521-4141, DOI 10.1002/(SICI)1521-4141(199809)28:093.0.CO;2-N, lire en ligne, consulté le )
- (en) R.M Steinman, « The control of immunity and tolerance by dendritic cells », Pathologie Biologie, vol. 51, no 2, , p. 59–60 (DOI 10.1016/S0369-8114(03)00096-8, lire en ligne, consulté le )
- (en) Caetano Reis e Sousa, « Dendritic cells in a mature age », Nature Reviews Immunology, vol. 6, no 6, , p. 476–483 (ISSN 1474-1733 et 1474-1741, DOI 10.1038/nri1845, lire en ligne, consulté le )
- (en) Ralph M. Steinman, « Decisions About Dendritic Cells: Past, Present, and Future », Annual Review of Immunology, vol. 30, no 1, , p. 1–22 (ISSN 0732-0582 et 1545-3278, DOI 10.1146/annurev-immunol-100311-102839, lire en ligne, consulté le )
- (en) D C Parker, « T Cell-Dependent B Cell Activation », Annual Review of Immunology, vol. 11, no 1, , p. 331–360 (ISSN 0732-0582 et 1545-3278, DOI 10.1146/annurev.iy.11.040193.001555, lire en ligne, consulté le )
- Elaine J. Schattner, « CD40 Ligand in CLL Pathogenesis and Therapy », Leukemia & Lymphoma, vol. 37, nos 5-6, , p. 461–472 (ISSN 1042-8194, PMID 11042507, DOI 10.3109/10428190009058499, lire en ligne, consulté le )
- T Cell-Independent Antigens Type 2 James J. Mond, Andrew Lees, and Clifford M. Snapper Annual Review of Immunology 1995 13:1, 655-692
- (en) Pierre-Grégoire Coulon, Clémence Richetta, Angéline Rouers et Fabien P. Blanchet, « HIV-Infected Dendritic Cells Present Endogenous MHC Class II–Restricted Antigens to HIV-Specific CD4 + T Cells », The Journal of Immunology, vol. 197, no 2, , p. 517–532 (ISSN 0022-1767 et 1550-6606, DOI 10.4049/jimmunol.1600286, lire en ligne, consulté le )
- (en) Lélia Delamarre et Ira Mellman, « Harnessing dendritic cells for immunotherapy », Seminars in Immunology, vol. 23, no 1, , p. 2–11 (DOI 10.1016/j.smim.2011.02.001, lire en ligne, consulté le )
- (en) Steffen Jung, Derya Unutmaz, Phillip Wong et Gen-Ichiro Sano, « In Vivo Depletion of CD11c+ Dendritic Cells Abrogates Priming of CD8+ T Cells by Exogenous Cell-Associated Antigens », Immunity, vol. 17, no 2, , p. 211–220 (DOI 10.1016/S1074-7613(02)00365-5, lire en ligne, consulté le )
- (en) Elodie Segura et Sebastian Amigorena, « Cross-Presentation in Mouse and Human Dendritic Cells », dans Advances in Immunology, vol. 127, Elsevier, (ISBN 978-0-12-802245-0, DOI 10.1016/bs.ai.2015.03.002, lire en ligne), p. 1–31
- (en) Nicola Harris et William C. Gause, B cell function in the immune response to helminths, Trends Immunol. Février 2011 ; 32(2): 80–88.
Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]
- Ressource relative à la santé :








