La morphogenèse est l'ensemble des lois qui déterminent la forme, la structure des tissus, des organes et des organismes. Par extension, on parle aussi de morphogenèse dans d'autres domaines comme celui de la formation de villes.
Introduction
La morphogenèse est une science qui est étudiée depuis la Grèce ancienne. La racine grecque « morph » signifie forme et « genèse » signifie formation[1].
Définitions
Plusieurs définitions selon le domaine considéré :
- Processus de développement des structures d'un organisme au cours de son embryogenèse ou de sa phylogenèse ;
- Processus de formation du relief de l'écorce terrestre, son étude permet de comprendre l'origine et le façonnement des formes de relief (voir aussi géomorphologie, géomorphogenèse ou glyptogenèse) ;
- Processus de création d'un ensemble de formes urbaines (théorie de la morphogenèse urbaine) ;
- Processus de développement de la connaissance humaine (épistémologie morphogénétique) considéré comme étant celui de la noosphère en application de la théorie de la résonance morphique de Rupert Sheldrake.
Place de la morphogenèse dans le monde vivant
La morphogenèse représente, en biologie développementale, les changements que l’on peut observer au niveau structurel lors de l’embryogenèse, notamment, et les mécanismes moléculaires et cellulaires qui régulent ces changements. Ces changements de forme deviennent généralement de plus en plus complexes.
La morphogenèse, la division cellulaire et la différenciation cellulaire sont des processus nécessaires au développement d’un organisme[2]. La morphogenèse est le processus le plus complexe des trois à étudier, puisqu’il se définit en quatre dimensions (espace tridimensionnel et le temps) et implique l’interaction de milliers de molécules différentes[1]. De plus, il est relativement difficile de l'étudier puisqu’il est compliqué d’observer de manière directe ce qui se passe à l’intérieur d’un organisme lorsque celui-ci est en train de se développer. Pour ces raisons, les études morphogénétiques se font souvent sur des tissus fixés ou par l’analyse des propriétés de certaines molécules ou cellules synthétisées qui peuvent jouer un rôle dans la formation des tissus[3].
La morphogenèse constitue la dernière étape du développement embryonnaire. Au cours de cette étape développementale, les tissus, les organes et les différentes parties du corps subissent des réarrangements. Ces réarrangements dépendent notamment de l’adhérence intercellulaire et de l’adhérence ayant lieu entre les cellules et la matrice extracellulaire[4].
La morphogenèse est très différente chez les animaux et les végétaux. En effet, chez les animaux on observe une migration des cellules et des tissus, ce qui n’est pas le cas chez les végétaux. De plus, la morphogenèse et l’augmentation de la taille de l’organisme ne sont observées qu’au stade embryonnaire et au stade juvénile chez la plupart des animaux, tandis qu’elles sont observées tout au long de la vie des végétaux[2].
Histoire
Selon Conrad Hal Waddington
Le biologiste Conrad Hal Waddington est un des nombreux scientifiques ayant joué un rôle important dans l’histoire de la morphogenèse. Il a élaboré le concept de paysage épigénétique. Le paysage épigénétique est une métaphore qui permet d’expliquer qu’un organisme va emprunter une certaine trajectoire développementale parmi plusieurs trajectoires possibles, tel qu’une bille qui descend à travers des vallées[5].
Selon D’Arcy Wentworth Thompson

Le savant D’Arcy Wentworth Thompson a lui aussi contribué à l'histoire de la morphogenèse. Il explique dans son livre On Growth and Form (Forme et croissance, 1915) que la sélection naturelle à elle seule n'est pas responsable de la morphogenèse, mais que des forces mécaniques et des lois physiques sont également impliquées[6].
C’est également lui qui élabore la théorie des transformations qui pose que les changements de développement évoluent de façon coordonnée chez l’organisme, c’est-à-dire que les structures de l’organisme n’évoluent pas indépendamment les unes des autres[7].
Selon Alan Turing
Le mathématicien Alan Turing, influencé par les travaux de Thompson[réf. nécessaire], publie un article, « The Chemical Basis of Morphogenesis », dans lequel il présente un modèle biomathématique de la morphogenèse, basé sur sa théorie des systèmes de réaction-diffusion[8].
La découverte de l’ADN, ainsi que la biologie moléculaire et la biochimie, ont permis de mieux comprendre les mécanismes responsables de ce que Turing avait modélisé[réf. nécessaire][Quoi ?]. De nombreux morphogènes qui fonctionnent grâce à un gradient de diffusion ont ainsi été caractérisés[9].
Morphogenèse des cellules individuelles
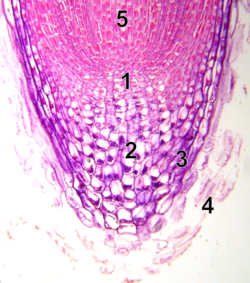
1. Méristème.
2. Columelle.
3. Partie latérale de la coiffe.
4. Cellules mortes.
5. Zone d'élongation.
La morphogenèse d’un organisme dépend, de manière plus ou moins directe, de la morphogenèse au niveau cellulaire: un changement dans la forme des cellules change la forme du tissu qu’elles composent. Ceci peut facilement être observé chez des organismes incapables de se déplacer activement, comme les plantes.
Certains tissus végétaux se développent par l’expansion des cellules et non pas par leur augmentation en nombre. Un exemple de ce genre de tissu est la racine. Le bout d’une racine est composé de deux zones ; une zone de prolifération et une zone d’expansion. Le changement de forme de la racine, soit son élongation, engendre une division cellulaire polarisée (zone de prolifération) ainsi qu’une expansion cellulaire (zone d’expansion). L’expansion des cellules va modifier leur propre forme et ainsi occasionner un changement dans la forme du tissu dans lequel elles se trouvent[1].
Division cellulaire

La division cellulaire, la mitose, permet d’augmenter le nombre de cellules et donc le volume d’un tissu en particulier chez un organisme. Selon la disposition spatiale que prennent les cellules venant de subir une division, un tissu peut prendre une nouvelle forme. Cette disposition spatiale est particulièrement importante tôt dans le développement de l’organisme, à la suite de la fécondation. L’orientation spatiale des cellules peut être soit radiale[10] ou spirale[11],[1].
Lorsque l’orientation est radiale, les cellules filles vont se positionner au même niveau spatial que les cellules mères dont elles émanent. Tandis que pour l’orientation spirale, les cellules filles vont se positionner au niveau des sillons qui séparent les cellules mères. Dans le cas de l’orientation spirale, la position des cellules filles peut altérer le phénotype de l’organisme. En effet, le positionnement des cellules filles peut induire une rotation du tissu, soit dans le sens horaire ou dans le sens antihoraire. C’est ce qui se produit chez l’escargot Lymnaea peregra. Si la rotation se fait dans le sens horaire, sa coquille sera « dextre »; dans le sens antihoraire, sa coquille sera « senestre ». Cette variation dans la position des cellules filles, toujours dans le cas de l’orientation spirale, peut jouer un rôle moins important chez d’autres organismes. Par exemple, chez la grenouille Xenopus laevis, la présence d'une telle variation dans le sens de rotation n’a aucun impact sur l’axe de symétrie de l’embryon[1].
L’orientation de la division cellulaire dans l'épithélium influence la morphogenèse tôt ou tard dans le développement. Elle peut notamment avoir un rôle important dans la neurulation chez les vertébrés[1].
La division cellulaire est également importante chez les plantes, car elles ne peuvent pas occasionner de réarrangements cellulaires. La division cellulaire chez les végétaux a lieu, entre autres, dans les racines. Les racines se forment par la multiplication de cellules dites « initiales », localisées dans le tissu méristématique. Ces cellules initiales correspondent aux cellules souches que l’on retrouve chez les animaux. Il en existe quatre sortes différentes, chacune responsable de la formation de différentes structures. Ces cellules formeront le péricycle et le tissu vasculaire, la columelle, le cortex et l’endoderme ainsi que l’épiderme. La division et l’expansion de ces cellules initiales permettent donc aux végétaux de former des racines[1].
Mort cellulaire programmée
La mort cellulaire programmée, aussi appelée apoptose, peut influencer la morphogénèse de deux manières principales. Elle peut permettre de former de façon directe une nouvelle structure et elle peut permettre d’éliminer l’accumulation de cellules non nécessaires lors d’un processus morphogénétique. Un bon exemple est celui de la formation des doigts chez l’être humain qui implique la mort cellulaire programmée d’une partie des cellules. En effet, la main ressemble d’abord à une palme puis l’apoptose permet de dégrader les cellules interdigitales afin de former les doigts. La matrice extracellulaire qui se retrouve dans ces régions interdigitales est quant à elle dégradée par des protéases[1]. L'inhibition de cette apoptose conduit à des morphologies de membres différents (comme la patte postérieure palmée des canards ou l'aile de la chauve-souris).
Différenciation cellulaire
La différenciation cellulaire est régulée par des gènes régulateurs qui contrôlent l’expression d’autres gènes dans le temps. La morphogenèse, quant à elle, est régulée par des gènes régulateurs qui contrôle la fréquence et la direction de la division cellulaire et la migration des cellules précédant leur prolifération[12]. La différenciation cellulaire est le processus par lequel une cellule acquiert des fonctions et des structures spécialisées. Cette différenciation permet l’organisation des cellules en tissu et organe. Elle est principalement causée par une variation de l’expression génique, c’est-à-dire l’activation ou l’inactivation de certains gènes[2].
Migration et adhérence cellulaire
La réorganisation du cytosquelette est à l’origine du changement de forme d’une cellule. Il est aussi à l’origine de la migration cellulaire[13]. La migration cellulaire peut engendrer un mouvement morphogénétique nommé « convergence-extension »[14], qui se caractérise soit par l’augmentation de la surface d’un tissu, soit par l’augmentation de sa longueur. Ceci se fait via la réorganisation des cellules d’une couche de tissu, causant le rétrécissement du tissu au niveau de l’intercalation des tissus (convergence) et l’allongement de ces mêmes cellules dans le sens perpendiculaire à l’intercalation des tissus (extension)[2].
On pense que la migration cellulaire se fait via la matrice extracellulaire, qui est composée de glycoprotéines situées à l’extérieur de la membrane plasmique des cellules. Ces glycoprotéines serviraient à guider les cellules migratrices. Les fibronectines, par exemple, contribuent à la migration cellulaire en permettant aux cellules migratrices de se fixer au collagène. Certaines molécules présentes dans la matrice cellulaire ont également un rôle inhibiteur, afin d’empêcher les cellules migratrices de se déplacer dans des directions non désirées. Ceci permet de guider la migration. Les cellules migratrices possèdent des récepteurs qui leur permettent de réagir en fonction de leur environnement. Rendues à leur destination, les cellules migratrices sont maintenues en place par la matrice extracellulaire, permettant ainsi la formation de tissu et d’organe[2].
Les molécules d’adhérence cellulaire, situées à la surface des cellules, interagissent avec d’autres molécules adhérentes localisées sur les cellules voisines. Ceci joue un rôle dans la migration cellulaire et dans le maintien des tissus et des organes. La nature chimique et le nombre de molécules adhérentes à la surface des cellules diffèrent selon le type cellulaire, ce qui permet de réguler la migration et la formation des tissus. La plus importante molécule d’adhérence est la cadhérine, qui nécessite la présence d’ions calcium afin d’être activée[2].
Études de la morphogenèse chez différents organismes
Morphogenèse des plumes : un modèle pour l’Évo-Dévo

La formation des plumes aviaires pourrait servir de modèle en Évo-Dévo. Chez les oiseaux, lors de la morphogenèse, des bourgeons de plumes apparaissent de manière à former un axe antéro-postérieur ainsi qu’un axe proximo-distal[15]. De ces bourgeons vont émaner les différentes structures de la plume : le rachis, les barbes et les barbules. Un changement dans la taille, l’angle ou la symétrie d’une de ces trois structures peut produire différentes formes de plume. Un des buts principaux en Évo-Dévo est de comprendre la base moléculaire des processus développementaux et de comprendre comment une modification des voies de signalisation moléculaire peut altérer le développement. Un changement dans le développement peut mener à un changement de phénotype et peut donc potentiellement causer un impact dans l’évolution[15]. En modulant les voies de signalisation moléculaire responsables du développement tégumentaire chez le poulet, par exemple, il serait possible d’analyser les processus moléculaires des différents paramètres morphogénétiques responsables de la formation des plumes[15]. La morphogenèse des plumes aviaires pourrait donc servir de modèle dans le cadre des études d’Évo-Dévo.
Morphogenèse chez l’amphibien Ensatina eschscholtzii
Des analyses comparatives sur les mécanismes cellulaires de la morphogenèse chez plusieurs amphibiens ont démontré qu’il existait une grande variabilité dans le développement précoce de ces organismes. Cette variabilité pourrait possiblement s’expliquer par la taille de l’œuf, la division cellulaire et la gastrulation[16]. Une étude ayant pour but de déterminer comment la taille et le vitellus d’un œuf peuvent influencer le développement précoce des amphibiens a été réalisée. Pour ce faire, une analyse de la division cellulaire, de la gastrulation ainsi que de la neurulation a été réalisée chez Ensatina eschscholtzii, une salamandre de la famille des Plethodontidae[16]. Les processus ontogéniques qui ont lieu lors du développement précoce étaient considérés auparavant comme étant conservés dans l’évolution, mais cette étude démontre qu’il existe en fait une certaine variabilité. Il existe, par exemple, des variations au niveau de la position initiale des tissus précurseurs ainsi qu’au niveau des mécanismes cellulaires responsables de plusieurs mouvements morphogénétiques similaires. Les urodèles et la plupart des anoures, deux ordres d’amphibiens différents, possèdent à la surface de l’épithélium de la zone marginale des tissus précurseurs du mésoderme. Xenopus, qui fait partie de l’ordre des anoures, quant à lui, en possède très peu. Xenopus possède cependant plusieurs mécanismes cellulaires qui contrôle le mouvement d’involution (mouvement qui permet aux tissus de s’enrouler sur eux-mêmes) de la zone marginale, incluant la migration du mésoderme le long du toit du blastocœle et la convergence-extension du mésoderme et de la crête neurale. La convergence-extension du mésoderme uniquement est suffisante pour induire l’involution et d’autres mouvements de la gastrulation chez Xenopus. Au contraire, la migration du mésoderme au niveau du toit du blastocœle est nécessaire à la gastrulation chez les Pleurodèles (ordre des urodèles). La convergence-extension des salamandres n'a lieu qu’à la fin de la gastrulation et pendant la neurulation[16]. La grosseur de l’œuf et de son contenu en vitellus influence la division cellulaire, la blastulation et la gastrulation dans un contexte morphogénétique. Plus l’œuf est gros, plus le développement est lent. Chez les amphibiens, les œufs de plus grosse taille induisent certains changements significatifs et prévisibles dans le développement précoce. Ceci est vrai pour plusieurs ordres d’amphibiens, mais le contexte phylogénétique doit malgré tout est pris en compte lorsqu'on analyse le rythme du développement précoce ou lorsqu'on analyses les mécanismes morphogénétiques[16].
Cascade de signalisation Wnt chez les chordés
Wnt est une protéine qui joue un rôle important dans la communication cellulaire lors de l’embryogenèse[17]. Cette protéine influence la symétrie et la morphogenèse lors du développement post-embryonnaire chez les chordés coloniaux[18]. Les protéines de la famille Wnt régulent les interactions cellulaires et contrôlent ainsi la prolifération, la différenciation, la migration et la polarité des cellules et des tissus. Ces protéines jouent un rôle dans trois voies de signalisation cellulaires principales : la voie de la polarité cellulaire planaire (PCP), la voie Wnt/calcium et la voie canonique. La signalisation cellulaire de Wnt responsable de la formation de l’axe de symétrie lors de la régénération ou du développement précoce est très conservée. La modulation de la signalisation de Wnt dans ces processus induit des phénotypes atypiques. Botryllus schlosseri, un chordé colonial de la classe des Ascidiaecea, a la capacité de régénérer tout son corps via le bourgeonnement, qui est un type de multiplication asexuée. Cette multiplication asexuée va permettre à ce chordé de se développer sans passer par les stades de développement embryonnaires. Une étude a démontré le rôle de la voie de signalisation canonique de Wnt dans le processus de bourgeonnement.
Trois ligands de Wnt ont été identifiés par hybridation in situ et RT-PCR (transcription inverse suivie d’une PCR) : Wnt2B, Wnt5A et Wnt9A. Cette étude a démontré qu’une modulation chimique de cette voie de signalisation engendrait un bourgeonnement anormal à cause d'une duplication des axes antéro-postérieur, des bourgeons surnuméraires et de la perte de la polarité apicale/basale des cellules[18]. La voie de signalisation de Wnt influencerait en effet, de manière égale, les processus de développement embryonnaires ainsi que les processus de bourgeonnement. Ceci suggère la conservation des mécanismes morphogénétiques, que ce soit dans le contexte du développement embryonnaire ou régénératif[18]. La sur-activation de la voie canonique de Wnt confère la capacité à un tissu non régénératif de se régénérer. La modulation de la voie de signalisation Wnt, en bloquant le complexe GSK-3ß chez Botryllus schlosseri, cause une perturbation dans la formation de l’axe antéro-postérieur et engendre donc un développement asymétrique lors de son cycle de reproduction asexuée.
Plusieurs études affirment que la voie de signalisation Wnt aurait joué un rôle important dans l’origine évolutive de la multicellularité chez les animaux. Cette voie de signalisation est conservée chez les chordés durant l’embryogenèse, la métamorphose, la régénération et la reproduction asexuée[18].
Notes et références
- (en) Jamie A. Davies, Mechanisms of morphogenesis, Amsterdam, Elservier Academic Press, .
- Neil A. Campbell et Jane B. Reece, Biologie, Saint-Laurent, ERPI, (ISBN 978-2-7613-1783-2).
- ↑ (en) Jonathan Bard, Morphogenesis : The Cellular and Molecular Processes of Developmental Anatomy, New York, Cambridge University Press, .
- ↑ Mr Harvey Lodish, Mr Arnold Berk, Paul Matsudaira et James Darnell, Biologie moléculaire de la cellule, De Boeck Supérieur, , 1096 p. (ISBN 978-2-8041-4802-7, lire en ligne).
- ↑ (en) Brian K. Hall, Evolutionary Developmental Biology, Springer Science & Business Media, , 491 p. (ISBN 978-0-412-78580-1, lire en ligne).
- ↑ (en) Denise J. Montell, Morphogenetic Cell Movements: Diversity from Modular Mechanical Properties, vol. 322, Science (journal), , 1502–1505 p. (PMID 19056976, DOI 10.1126/science.1164073, Bibcode 2008Sci...322.1502M, S2CID 27982230, lire en ligne [archive du ]), chap. 5907.
- ↑ « On growth and form », sur archive.org (consulté le ).
- ↑ (en) Michele Emmer, Imagine Math 2 : Between Culture and Mathematics, Springer Science & Business Media, , 262 p. (ISBN 978-88-470-2889-0, lire en ligne).
- ↑ Patrick Pla, « Les inductions embryonnaires et les gradients de morphogènes »
 , sur Biologie cellulaire et génétique du développement (consulté le ).
, sur Biologie cellulaire et génétique du développement (consulté le ).
- ↑ Voir sur youtube.com.
- ↑ Voir sur youtube.com.
- ↑ (en) J. William Schopf, The Proterozoic Biosphere : A Multidisciplinary Study, Cambridge University Press, , 1348 p. (ISBN 978-0-521-36615-1, lire en ligne).
- ↑ Patrick Pla, « Les migrations cellulaires »
 , sur Biologie cellulaire et génétique du développement (consulté le ).
, sur Biologie cellulaire et génétique du développement (consulté le ).
- ↑ Voir sur youtube.com.
- Randall B. Widelitz, Ting Xin Jiang, Mingke Yu et Ted Shen, « Molecular biology of feather morphogenesis: a testable model for evo-devo research », Journal of Experimental Zoology. Part B, Molecular and Developmental Evolution, vol. 298, no 1, , p. 109–122 (ISSN 1552-5007, PMID 12949772, PMCID 4382008, DOI 10.1002/jez.b.29, lire en ligne, consulté le ).
- Andres Collazo et Ray Keller, « Early development of Ensatina eschscholtzii: an amphibian with a large, yolky egg », EvoDevo, vol. 1, , p. 6 (ISSN 2041-9139, PMID 20849648, PMCID 2938725, DOI 10.1186/2041-9139-1-6, lire en ligne, consulté le ).
- ↑ Voir sur youtube.com.
- Alessandro Di Maio, Leah Setar, Stefano Tiozzo et Anthony W. De Tomaso, « Wnt affects symmetry and morphogenesis during post-embryonic development in colonial chordates », EvoDevo, vol. 6, , p. 17 (PMID 26171140, PMCID 4499891, DOI 10.1186/s13227-015-0009-3, lire en ligne, consulté le ).
Voir aussi
Bibliographie
- (en) Alan Turing, « The Chemical Basis of Morphogenesis » (1952), Philosophical Transactions of the Royal Society B: Biological Sciences, Vol 237,n° 641, pp. 37-78.
- René Thom, « Stabilité structurelle et morphogenèse » (1972, 2e éd. revue, corrigée et augmentée), InterEditions, Paris (ISBN 2-7296-0081-7).
- Peter S. Stevens, Les Formes dans la nature (1978), Le Seuil, coll. « Science ouverte » (ISBN 2-02-004813-2)
- Pierre-François Puech, « Morphogenèse et phylogenèse : comment l'homme s'est-il constitué à partir de ses ancêtres ? » (2006), EMC éd. Elsevier SAS, Paris, Stomatologie,22-003-S-12, Doi : 10.1016/S0000-0000(08)53152-4.
- Vincent Fleury :
- De l'œuf à l'éternité, Flammarion, 2006 (ISBN 2-08-210560-1)
- Les Tourbillons de la vie ; une simple histoire de nos origines, Paris, Fayard, 2017 (ISBN 978-2-213-70184-4)
- Philip Ball, « Vers une ingénierie des formes vivantes ? », Pour la science, no 550, , p. 34-42.
Articles connexes
Liens externes
- Études de la morphogenèse
- Morphogenèse : les structures de Turing existent bien, sur futura-sciences.com








