En chimie organique, les nitrophénols sont une famille de composés aromatiques constitués d'un cycle benzénique substitué par un groupe hydroxyle (phénol) ainsi que par un ou plusieurs groupes nitro, qui ont pour formule générale HOC6H5-X(NO2)X. Ils sont usuellement produits par nitration du phénol par l'acide nitrique concentré. De nombreux composés se distinguent par leur couleur jaune intense. En tant que tel, le terme « nitrophénol » a plus tendance à désigner les composés mono-nitratés (« mononitrophénols »). Parmi les composés les plus importants de cette famille, on compte le 2,4-dinitrophénol (2,4-DNP) et l'acide picrique (2,4,6-trinitrophénol).
Propriétés
Acidité
| pKA de divers nitrophénols | ||||
| Nom | Phénol | 4-Nitrophénol | 2,4-Dinitrophénol | Acide picrique |
| Structure | 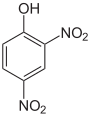 |

| ||
| pKA[1] | 9,99 | 7,16 | 4,09 | 0,29 |
Le phénol présente un caractère (très) faiblement acide par son groupe hydroxyle. Cela s'explique du fait de la relative stabilisation de l'ion phénolate par mésomérie provenant du cycle benzénique. Les groupes nitro jouent un double rôle dans l'accroissement de ce caractère acide, par leur effet -I et -M. L'effet inductif attracteur (-I) du ou des groupes nitro augmente la polarité de la liaison O-H, et favorise ainsi le départ de l'ion H+. L'effet mésomère -M quant à lui augmente la stabilité de l'anion issu du départ de H+, en permettant une délocalisation plus importante du nouveau doublet libre, et de la charge négative. Ces effets sont croissants avec le nombre de substituants nitro, et ils sont d'autant plus importants si ceux-ci occupent une position ortho ou para sur le cycle (positions 2, 4 et 6). Cet effet s'observe de façon flagrante avec le 2,4,6-trinitrophénol, appelé couramment acide picrique, dont l'acidité est comparable à celle des acides minéraux.
Sécurité
Les nitrophénols sont toxiques par inhalation, ingestion et contact avec la peau. Ils provoquent des irritations aux yeux, à l'appareil digestif, aux voies respiratoires, un empoisonnement du sang, des lésions du foie, des vertiges, des nausées et des maux de tête. Ils ont un effet toxique sur le système nerveux des êtres vivants. Ils peuvent être cancérigènes et sensibilisants. Ces effets sont amplifiés en combinaison avec l'alcool. En cas de contact avec la peau, laver immédiatement et abondamment à l'eau.
Un problème majeur est l'élimination des nitrophénols et des composés apparentés des eaux souterraines. De telles contaminations se retrouvent parfois dans d'anciennes usines d'explosifs ou de peinture, et dans des installations militaires.
Utilisations
Les nitrophénols sont produits dans les industries chimique, pharmaceutique et de défense, comme intermédiaires, notamment dans la production de peintures, cuir, caoutchouc, pesticides, fongicides, pesticides et munitions.
Sous-familles
Mononitrophénols
Le mononitrophénol, ou plus simplement nitrophénol, est constitué d'un cycle benzénique substitué par un groupe hydroxyle (phénol) et un groupe nitro. Il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
| Nitrophénol | |||
| Nom | 2-Nitrophénol | 3-Nitrophénol | 4-Nitrophénol |
| Autres noms | o-Nitrophénol Orthonitrophénol 1-Hydroxy-2-nitrobenzène |
m-Nitrophénol Métanitrophénol 1-Hydroxy-3-nitrobenzène |
p-Nitrophénol Paranitrophénol 1-Hydroxy-4-nitrobenzène |
| Représentation | 
|

|
|
| Formule brute | C6H5NO3 | ||
Dinitrophénols
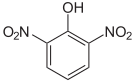
Le dinitrophénol est constitué d'un cycle benzénique substitué par un groupe hydroxyle et deux groupes nitro. Il existe sous la forme de six isomères dont le plus courant est le 2,4-dinitrophénol.
| Dinitrophénols | ||||||
| Nom | 2,3-Dinitrophénol | 2,4-Dinitrophénol | 2,5-Dinitrophénol | 2,6-Dinitrophénol | 3,4-Dinitrophénol | 3,5-Dinitrophénol |
| Représentation | 
|

|

|
|

|

|
| Formule brute | C6H4N2O5 | |||||
Trinitrophénols
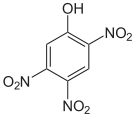
Le trinitrophénol est constitué d'un cycle benzénique substitué par un groupe hydroxyle et trois groupes nitro. Il existe sous la forme de six isomères dont le plus courant est le 2,4,6-trinitrophénol, plus connu sous le nom d'acide picrique.
| Trinitrophénols | ||||||
| Nom | 2,3,4-Trinitrophénol | 2,3,5-Trinitrophénol | 2,3,6-Trinitrophénol | 2,4,5-Trinitrophénol | 2,4,6-Trinitrophénol (Acide picrique) |
3,4,5-Trinitrophénol |
| Représentation | 
|

|

|
|

|

|
| Formule brute | C6H3N3O7 | |||||
Tétra- et pentanitrophénols
Le 2,3,4,6-tétranitrophénol (C6H2N4O9) est si instable et explosif qu'il ne peut être transporté. Le pentanitrophénol (C6HN5O11) est un produit de l'hydrolyse de l'hexanitrobenzène.
| Tétra- et pentanitrophénols | ||||
| Nom | 2,3,4,5-Tétranitrophénol | 2,3,4,6-Tétranitrophénol | 2,3,5,6-Tétranitrophénol | Pentanitrophénol |
| Représentation | 
|

|

|

|
| Formule brute | C6H2N4O9 | C6HN5O11 | ||
| Masse molaire | 274,10 g mol−1 | 319,10 g mol−1 | ||
| Numéro CAS | ||||
| PubChem | 21523193 | 61190 | ||
Notes et références
- CRC Handbook of Tables for Organic Compound Identification, CRC Press/Taylor & Francis, Boca Raton, FL, 1967 (ISBN 0-8493-0303-6), Acid Dissociation Constants of Phenols in Aqueous Solution, p. 434.








