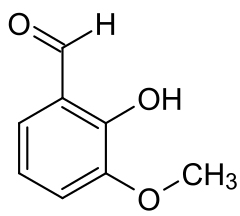
| Orthovanilline | |
| |
| Identification | |
|---|---|
| Nom UICPA | 2-hydroxy-3-méthoxybenzaldéhyde |
| Nom systématique | 2-hydroxy-3-méthoxybenzaldéhyde |
| Synonymes |
o-vanilline |
| No CAS | |
| No ECHA | 100.005.197 |
| No CE | 205-715-3 |
| PubChem | 8991 |
| SMILES | |
| InChI | |
| Apparence | cristaux jaune pâle[1] |
| Propriétés chimiques | |
| Formule | C8H8O3 [Isomères] |
| Masse molaire[2] | 152,147 3 ± 0,007 9 g/mol C 63,15 %, H 5,3 %, O 31,55 %, |
| Propriétés physiques | |
| T° fusion | 40 à 42 °C[3] |
| T° ébullition | 265 à 266 °C[3] |
| Solubilité | 5,37 mol·L-1 (THF) 3,04 mol·L-1 (éthanol) 2,27 mol·L-1 (méthanol) |
| Précautions | |
| SGH[3] | |
| H302, H315, H319, H335, P261 et P305+P351+P338 |
|
| Écotoxicologie | |
| DL50 | 1 330 mg·kg-1 (souris, oral)[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'orthovanilline, o-vanilline ou 2-hydroxy-3-méthoxybenzaldéhyde est un composé organique aromatique de formule brute C8H8O3. Elle est constituée d'un cycle benzénique substitué par un groupe formyle (HC=O), un groupe hydroxyle (OH) et un groupe méthoxyle (OCH3), respectivement aux positions 1, 2 et 3.
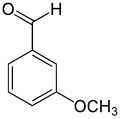
Elle est structurellement très proche de son isomère, la (para)vanilline, qui peuvent être considérées comme des dérivés du 3-méthoxybenzaldéhyde avec un groupe hydroxyle supplémentaire, en position 2 (ortho) pour l'orthovanilline et en position 4 (para) pour la vanilline.
-
3-Méthoxybenzaldéhyde
-
orthovanilline
-
(para)vanilline
L'orthovanilline diffère sensiblement de son isomère : elle ne possède pas l'odeur intense et caractéristique de vanille, et n'a donc pas d'usage alimentaire ou en parfumerie ; elle est par conséquent bien moins souvent produite et rencontrée.
Occurrence
L'orthovanilline est présente dans les extraits et huiles essentielles de nombreuses plantes[4],[5],[6].
Histoire
L'orthovanilline a été découverte en 1876 par le chimiste allemand Ferdinand Tiemann. En 1910, Francis Nölting développa des méthodes de synthèse pure et put également démontrer la polyvalence de ce composé comme précurseur synthétique d'une large série de composés, comme les coumarines[7]. En 1920, le composé était utilisé pour teindre les peaux d’animaux[8].
Propriétés
Propriétés physiques
L'orthovanilline forme des aiguilles cristallines jaune clair[1]. Elle fond à 43 à 45 °C et bout à 265 à 266 °C. Elle est soluble dans le THF, l'éthanol et le méthanol. Elle cristallise dans le système cristallin orthorhombique du groupe d'espace Fdd2 (n° 43) avec les paramètres de maille a = 2509.9 pm, b = 2452.2 pm, c = 479.1 pm, avec 16 unités de formule par maille[1].
Propriétés biologiques
L'orthovanilline est un inhibiteur faible de la tyrosinase[9] et présente des propriétés à la fois antimutagènes et comutagènes chez Escherichia coli[10],[11]. Elle possède des propriétés antifongiques et antibactériennes modérées[12].
Utilisations
L'orthovanilline peut être transformée en acide orthovanillique en la faisant fondre avec de l'hydroxyde de potassium. Celui-ci peut à son tour être mis à réagir avec le bromure d'hydrogène pour former l'acide 2,3-dihydroxybenzoïque :

De nos jours, la majeure partie de l'orthovanilline est utilisée dans l'étude de la mutagénèse et comme précurseur synthétique de produits pharmaceutiques, par exemple la bénafentrine[13] et un composé anti-androgène appelé pentomone (en).
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Ortho-Vanillin » (voir la liste des auteurs).
- F. Iwasaki, I. Tanaka, A. Aihara, « 2-Hydroxy-3-methoxybenzaldehyde (o-Vanillin) », Acta Cryst. B, vol. 32, no 4, , p. 1264–1266 (DOI 10.1107/S0567740876005086)
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé o-Vanillin, consultée le 2024-04-25.
- ↑ A. H. Abou Zeid, A. A. Sleem, « Natural and stress constituents from Spinacia oleracea L. leaves and their biological activities », Bulletin of the Faculty of Pharmacy, Cairo University, vol. 40, , p. 153–167
- ↑ Jean-Christophe Barbe, Alain Bertrand, « Quantitative analysis of volatile compounds stemming from oak wood. Application to the aging of wines in barrels », Journal des Sciences et Techniques de la Tonnellerie, , p. 77–88
- ↑ (de) E. J. Brunke, F. J. Hammerschmidt, G. Schmaus, « Das etherische Öl von Santolina chamaecyparissus L. (Santolina chamaecyparissus essential oil) », Parfümerie und Kosmetik, no 73, , p. 617–618, 623–624, 626, 628–630, 632, 634–637
- ↑ Francis A. M. Noelting, « o-Hydroxy-m-methoxybenzaldehyde (Orthovanillin) », Annales de chimie et de physique, vol. 19, , p. 476–550
- ↑ (de) Otto Gerngross, « Die Färbungen tierischer Haut durch o-Vanillin und o-Protocatechualdehyd und die Aldehydgerbung », Angewandte Chemie, vol. 33, no 44, , p. 136–138 (DOI 10.1002/ange.19200334403)
- ↑ Isao Kubo, Ikuyo Kinst-Hori, « Tyrosinase inhibitory activity of the olive oil flavor compounds », Journal of Agricultural and Food Chemistry, vol. 47, no 11, , p. 4574–4578 (DOI 10.1021/jf990165v)
- ↑ Kazuko Watanabe, Toshihiro Ohta, Yasuhiko Shirasu, « Enhancement and inhibition of mutation by o-vanillin in Escherichia coli », Mutation Research, vol. 218, no 2, , p. 105–109 (PMID 2671704, DOI 10.1016/0006-291x(89)90826-7)
- ↑ Kazuhiko Takahashi, Mutsuo Sekiguchi, Yutaka Kawazoe, « A specific inhibition of induction of adaptive response by o-vanillin, a potent comutagen », Biochemical and Biophysical Research Communications, vol. 162, no 3, , p. 1376–1381 (PMID 2669748, DOI 10.1016/0006-291x(89)90826-7)
- ↑ I. Leifertova, N. Hejtmankova, H. Hlava, J. Kudrnacova, F. Santavy, « Antifungal and antibacterial effects of phenolic substances. A study of the relation between the biological activity and the constitution of the investigated compounds », Acta Universitatis Palackianae Olomucensis, Facultatis Medicae, vol. 74, , p. 83–101
- ↑ Jeffery B. Press, Victor T. Bandurco, Elizabeth M. Wong, Zoltan G. Hajos, Ramesh M. Kanojia, Robert A. Mallory, Edward G. Deegan, James J. Mcnally, Jerry R. Roberts, Mary Lou Cotter, David W. Graden et John R. Lloyd, « Synthesis of 5,6-dimethoxyquinazolin-2(1H)-ones », Journal of Heterocyclic Chemistry, vol. 23, no 6, , p. 1821–1828 (ISSN 0022-152X, DOI 10.1002/jhet.5570230643)