![[CH2–CH]n–CONH–CH–(CH3)2](http://upload.wikimedia.org/wikipedia/commons/thumb/3/3c/NIPAM_formula.svg/220px-NIPAM_formula.svg.png)
Le poly(N-isopropylacrylamide) (abrégé en polyNIPAM, PNIPAM ou PNIPAAm) est un polymère thermosensible qui en milieu aqueux subit une transition réversible autour de 32 °C. Sous cette température critique inférieure de solubilité (LCST, lower critical solution temperature), il est hydrophile et gonflé ; au-delà, il devient hydrophobe et se recroqueville. Il est possible d'ajuster la LCST en combinant le NIPAM à d'autres monomères, en réalisant une copolymérisation. Le comportement original du PNIPAM en fait un polymère étudié pour de nombreuses applications. En optique, on envisage des applications telles que le filtrage et le réglage de longueur d'onde. Le principal domaine d'application du PNIPAM est celui des sciences du vivant ; le polymère est souvent conjugué à des objets biologiques (anticorps, enzymes, etc.) pour les rendre thermosensibles ; il est ainsi possible de réaliser des immuno-tests utilisant la précipitation par affinité basée sur un bioconjugué de PNIPAM. Le PNIPAM est aussi utilisé comme coque autour de solutés, pour des applications en administration de médicaments. Les couches de PNIPAM, hydrophobes à la température du corps humain, servent également de supports de culture de cellules et permettent une libération douce sans digestion enzymatique.
Polymère thermosensible
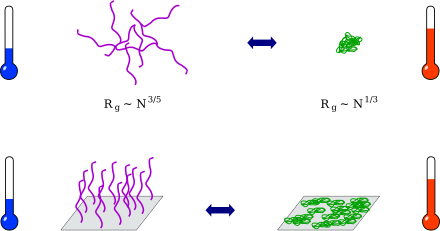
Un polymère est une macromolécule, en général organique, constituée de molécules élémentaires ayant la même nature chimique, les monomères. La réaction de polymérisation conduit à la formation de macromolécules, ayant une structure tridimensionnelle, par établissement de liaisons covalentes entre les monomères. Un polymère stimulable (stimuli-responsive polymer) subit une modification de ses propriétés physiques sous l'action d'un stimulus extérieur : pH, température, force ionique, champ électrique, rayonnement lumineux, etc.
Le poly(N-isopropylacrylamide) (PNIPAM, numéro CAS : ) est un polymère subissant une transition macromoléculaire réversible, d'un état hydrophile à un état hydrophobe, autour de sa température critique inférieure de solubilité (lower critical solution temperature, LCST)[1] ; cette transition est rapide et située entre 30 °C et 35 °C[2]. Sous sa température de transition, le PNIPAM est soluble dans l'eau, visqueux et gonflé. Au-delà de sa température de transition, il devient hydrophobe et insoluble dans l'eau ; il expulse l'eau et se replie sur lui-même afin de présenter une surface minimale à l'eau. Ce changement de conformation le rend opaque, solide et réduit drastiquement son encombrement stérique[3].
Production scientifique

En 1991, H. Schild dresse une revue extrêmement complète des travaux effectués sur le PNIPAM[4]. Il commence cette revue de 87 pages par un diagramme retraçant le nombre de publications scientifiques concernant le PNIPAM entre 1955 et . Avec un total d'environ trois cents références, il qualifie la croissance du nombre de publications de « plutôt explosive ». En , la même recherche effectuée selon le même protocole[Note 1] donne un total de 3 645 références et une progression réellement explosive.
Polymérisation
Le monomère du PNIPAM est le N-isopropylacrylamide (NIPAM) dont la structure contient celle de l'acrylamide ; il peut être polymérisé en PNIPAM de nombreuses façons : amorçage radicalaire en solution organique, amorçage redox en solution aqueuse, polymérisation ionique, etc.[4],[5] ; la polymérisation par plasma est plus récente[6]. La polymérisation peut être effectuée en solution ou sur une surface ; dans ce cas, il est généralement greffé par l'intermédiaire d'une couche de type silane. Le PNIPAM peut également être fixé sur du polystyrène, du PET (polytéréphtalate d'éthylène)[7] et du PEG (polyéthylène glycol)[8].
Bascule conformationnelle
Mécanisme réversible
La principale caractéristique du PNIPAM, qui en fait un polymère très utilisé, est sa transition d'un état gonflé et hydrophile (sous sa température de transition) à un état replié et hydrophobe (au-delà de la température de transition). En 1968, Heskins et al. attribuent cette « transition de phase » à un effet entropique, dû à la formation de liaisons hydrophobes[1]. Graziano et al. comparent la transition du PNIPAM à la renaturation à froid des petites protéines globulaires[9], considérée comme une transition moléculaire du premier ordre. La transition du PNIPAM a été observée par de nombreuses techniques de caractérisation, notamment par microbalance à quartz (quartz crystal microbalance, QCM)[10], [11], [12], [13].
Modification de la température de transition
La température de transition du PNIPAM (LCST) dépend fortement des conditions de polymérisation[14] ; Plunkett et al. montrent en 2006 l'influence du poids moléculaire et de la densité de greffage[15]. Des facteurs extérieurs influent également sur la LCST, comme le pH[16], la nature du solvant[17] et les sels présents dans la solution[18], [19]. Il est possible de modifier la température de transition en combinant le PNIPAM à d'autres polymères comme l'acrylamide[20] ; Rollason et al. formulent ainsi un copolymère NIPAM/N-t-butylacrylamide (NTBAM) avec une LCST de 8 °C[21]. D'autres équipes ont étudié plusieurs copolymères de NIPAM et remarqué que leur LCST augmente lorsque la fraction de NIPAM diminue[22].
Composante thermosensible
La copolymérisation de NIPAM avec d'autres monomères permet de synthétiser des gammes de copolymères thermosensibles ayant des températures de transition différentes[22]. L'association du NIPAM avec d'autres monomères est souvent utilisée pour leur adjoindre un comportement thermosensible[23], [24] ; il est ainsi possible de combiner les caractéristiques de plusieurs polymères : un copolymère NIPAM-acide méthacrylique est sensible à la fois à la température et au pH[25]. Cette démarche consistant à greffer le PNIPAM sur un micro-objet pour le rendre thermosensible est aussi utilisée dans les applications biologiques du PNIPAM : on conjugue par exemple du NIPAM avec des cellules, des protéines ou de l'ADN.
Applications en optique

Diffraction
Les propriétés originales du PNIPAM permettent d'envisager son intégration dans des systèmes nécessitant des actionneurs réversibles ; c'est notamment le cas en optique. Weissman et al. explorent ainsi l'intégration de PNIPAM dans un réseau colloïdal cristallin (crystalline colloidal array, CCA). Les molécules de PNIPAM gonflé, organisées en réseau cubique centré, n'entraînent qu'une faible diffraction de Bragg des rayonnements infrarouge, visible et ultraviolet, tandis qu'un réseau de PNIPAM replié les diffracte beaucoup plus. Ils étudient d'autre part l'intégration d'un CCA de sphères de polystyrène dans un hydrogel de PNIPAM : le changement conformationnel du PNIPAM entraîne un changement de la constante de réseau ; la température permet ainsi de contrôler la longueur d'onde diffractée sur tout le spectre visible[27].
Filtrage
Le repliement du PNIPAM lors de sa transition entraîne également une modification optique : il passe d'un état transparent à un état opaque ; il est envisageable de développer des filtres à base de PNIPAM. Mias et al. ont ainsi étudié la transmission d'un signal à 365 nm à travers une couche de PNIPAM ; ils observent une atténuation de 38 dB entre le PNIPAM gonflé et le PNIPAM replié[26].
Applications en sciences du vivant
Le principal domaine d'application du PNIPAM est celui du vivant et de la recherche biomédicale[28] : les chercheurs ont rapidement réalisé l'intérêt que représentait sa transition réversible, d'autant plus à une température proche de celle du corps humain. Les principaux travaux concernent les tests immunologiques (notamment la précipitation et la séparation), l'administration de médicaments (drug delivery), la culture de cellules et la conjugaison avec toutes sortes d'objets biologiques, tels que des protéines.
Tests immunologiques
En 1987, K. Auditore-Hargreaves, N. Monji et al. rapportent l'utilisation de PNIPAM comme phase dans un immuno-test[22], [29]. Les anticorps, greffés sur des chaînes de PNIPAM, réagissent avec les antigènes ; un deuxième anticorps fluorescent permet la visualisation ; en augmentant ensuite la température, la « précipitation thermique » a lieu : des particules de PNIPAM non soluble se forment et concentrent la fluorescence, qui est proportionnelle à la quantité d'antigènes en solution. Les anticorps testés n'ont pas d'influence sur la LCST[22]. Cette technique a ensuite été étendue à un immuno-test sur membrane[30] et la formulation du polymère a été perfectionnée[31]. L'avantage des tests immunologiques en solution par rapport aux tests sur supports est qu'il n'y a pas de problème de limitation de la diffusion[32]. La précipitation par affinité repose sur des bioconjugués thermosensibles[33], [34], [35] ; les objets biologiques utilisés sont généralement des anticorps, plus rarement des protéines[36]. Une fois la réaction spécifique effectuée, le polymère est stimulé afin d'entraîner la précipitation ; il peut s'agir de PNIPAM ou de copolymères de NIPAM[37]. Par ailleurs, le PNIPAM est aussi utilisé pour la concentration de virus[38] et la purification d'anticorps[39].

Administration de médicaments
La transition du PNIPAM autour de 32 °C permet de piéger des solutés dans des capsules de PNIPAM, progressivement activées par la température du corps humain[40], [41], [42], [43]. Des études in vivo d'administration d'héparine, un anticoagulant, sont réalisées dès 1995[44]. Lin et al. ont également conçu un pansement pour blessures utilisant le PNIPAM pour l'administration de médicament[45]. Les résultats prometteurs d'encapsulation et de libération de solutés ont suscité des études sur les effets de l'environnement (éventuellement physiologique) sur les propriétés du PNIPAM et sa LCST[19] : les sels ont une tendance générale à diminuer la LCST ; chaque surfactant a une influence particulière. La salive et les sécrétions gastro-intestinales ont un effet limité sur la LCST du PNIPAM, rendant ainsi possible son utilisation pour l'ingestion orale de médicaments. L'influence des sels sur la LCST a d'ailleurs été mise à profit pour concevoir un composé incluant des sels qui retardent la distribution de médicament dans le milieu[46]. Le seuil de filtration glomérulaire des copolymères de PNIPAM est de 32 000 g/mol[47]. Sa nature non-biodégradable empêche donc les molécules plus grosses d'être filtrées par le rein et d'être éliminées de la circulation sanguine.
Culture de cellules
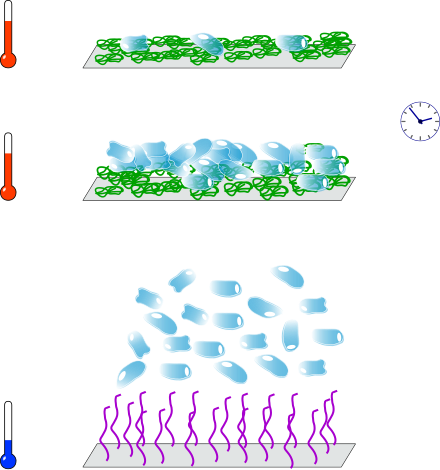
Les cellules ont une affinité particulière pour les surfaces hydrophobes ; à l'inverse, les surfaces hydrophiles ont tendance à les repousser. Il est donc intéressant d'utiliser les surfaces de PNIPAM comme substrat de culture cellulaire[48], [49]. Les conditions environnementales nécessaires à la culture de cellules humaines, notamment la température de 37 °C, sont compatibles avec l'état replié du PNIPAM ; par ailleurs, la couche chimique de PNIPAM sert d'interface souple entre la surface et les cellules. Celles-ci s'accrochent sur le PNIPAM hydrophobe et y prolifèrent ; quand la culture arrive à terme, une baisse de la température sous la LCST du PNIPAM entraîne le décrochage des cellules ; cette libération douce permet de s'affranchir des méthodes de digestion enzymatique à base de trypsine[50]. Les cellules cultivées sur PNIPAM conservent des caractéristiques fonctionnelles très proches de celles des cellules originales ; elles peuvent également conserver des phénotypes différenciés[51], [52] ; au contraire, l'utilisation de trypsine peut endommager les cellules ou perturber leur métabolisme[53], [54]. Il est même possible de dessiner des motifs pour réaliser une coculture de deux types de cellules[55]. Le NIPAM peut être associé à un ou plusieurs autres monomères pour former des substrats de culture copolymères[56], [57], parfois recouverts d'une couche intermédiaire de protéines[58]. Okano et al. ont par ailleurs démontré que le métabolisme des cellules a une influence sur leur détachement[59].
Conjugaisons
Le PNIPAM est conjugué avec de multiples objets biologiques, pour leur conférer un caractère thermosensible. C'est par exemple le cas de l'ADN[60], dont le conjugué est notamment utilisé pour la séparation d'enzymes[61] ; des copolymères de NIPAM sont également utilisés comme vecteurs d'ADN[62], [63]. Les enzymes comme la trypsine peuvent, elles aussi, être conjuguées à du PNIPAM[64], [65], [66], tout en conservant une grande partie de leur activité[67]. À l'inverse, Sigolaeva et al. ont montré qu'une enzyme incluse de façon covalente dans la matrice d'un gel de PNIPAM voit son activité réduite au-delà de la LCST[68].
Le PNIPAM peut aussi être conjugué à des protéines qui n'ont généralement pas d'influence sur la LCST[69]. Le PNIPAM a ainsi été fixé à des macromolécules de streptavidine près du site de reconnaissance de la biotine ; la reconnaissance a lieu normalement sous la LCST ; au-dessus de la LCST, le PNIPAM s'effondre et bloque la formation du lien streptavidine-biotine[70]. La même équipe a plus tard réussi à utiliser le PNIPAM pour contrôler thermiquement l'accrochage et le décrochage de biotine sur la streptavidine[71].
Purification des protéines

Le PNIPAM peut être utilisé comme support d'adsorption de protéines, de la même manière que pour les cellules[8] ; cela permet d'envisager des applications en préparation d'échantillons ou en purification des protéines[72], notamment en protéomique. Plusieurs équipes ont étudié l'accrochage de protéines fluorescentes sur du PNIPAM[73], [74] ou des copolymères de NIPAM[75], y compris sur des surfaces mobiles[76].
Autres usages
Le PNIPAM est utilisé pour des travaux plus originaux, tel que dans le domaine de la neurochirurgie intravasculaire : le PNIPAM a ainsi été étudié in vivo pour obstruer des vaisseaux sanguins et générer une embolie[77]. Matsubara et al. ont utilisé ses propriétés thermiques pour préconcentrer du phosphate et le doser optiquement. La contraction d'un gel de PNIPAM au-dessus de la LCST permet de bloquer la diffusion d'espèces dans ce gel, comme le glucose ou l'insuline[78]. Par ailleurs, le PNIPAM a ouvert la voie de la séparation par chromatographie thermosensible, liquide[79], [80] ou par exclusion de taille[81].
Notes et références
Notes
- Schild effectue sa recherche sur les Chemical Abstracts Online Search le 7 août 1991 ; sa recherche est basée sur (numéro CAS du polymère) ou (numéro CAS du monomère) ou [polymer? et N-isopropylacrylamide] sur les bases de données CA et CAOLD. La recherche plus récente a été effectuée avec SciFinder Scholar le 13 mai 2008 sur la base de données CAplus en utilisant les identifiants CAS du polymère et du monomère. Les doublons ont été enlevés automatiquement.
Références
- (en) M. Heskins & J.E. Guillet, « Solution properties of poly(N-isopropylacrylamide) », J. Macromol. Sci. Part A Pure Appl. Chem., vol. 2, no 8, , p. 1441–1455 (DOI 10.1080/10601326808051910)
- (en) X.-Z. Zhang, F.-J. Wang & C.-C. Chu, « Thermoresponsive hydrogel with rapid response dynamics », J. Mater. Sci. Mater. Med., vol. 14, no 5, , p. 451–455 (DOI 10.1023/A:1023219019500)
- (en) H. Yim, M.S. Kent, S. Mendez, S.S. Balamurugan, S. Balamurugan, G.P. Lopez & S. Satija, « Temperature-dependent conformational change of pnipam grafted chains at high surface density in water », Macromolecules, vol. 37, no 5, , p. 1994–1997 (DOI 10.1021/ma0354290)
- (en) H.G. Schild, « Poly(N-isopropylacrylamide): Experiment, theory and application », Prog. Polym. Sci., vol. 17, no 2, , p. 163–249 (DOI 10.1016/0079-6700(92)90023-R)
- (en) R. Pelton, « Temperature-sensitive aqueous microgels », Adv. Colloid. Interface Sci., vol. 85, no 1, , p. 1–33 (DOI 10.1016/S0001-8686(99)00023-8)
- (en) Y.V. Pan, R.A. Wesley, R. Luginbuhl, D.D. Denton & B.D. Ratner, « Plasma polymerized N -isopropylacrylamide: Synthesis and characterization of a smart thermally responsive coating », Biomacromolecules, vol. 2, no 1, , p. 32–36 (DOI 10.1021/bm0000642)
- (en) P.S. Curti, M.R. De Moura, E. Radovanovic, A.F. Rubira, E.C. Muniz & R.A. Moliterno, « Surface modification of polystyrene and poly(ethylene terephtalate) by grafting poly(N-isopropylacrylamide) », J. Mater. Sci. Mater. Med., vol. 13, no 12, , p. 1175–1180 (DOI 10.1023/A:1021154424189)
- (en) P. Heinz, F. Bretagnol, I. Mannelli, L. Sirghi, A. Valsesia, G. Ceccone, D. Gilliland, K. Landfester, H. Rauscher et F. Rossi, « Poly(N -isopropylacrylamide) grafted on plasma-activated poly(ethylene oxide): Thermal response and interaction with proteins », Langmuir, vol. 24, no 12, , p. 6166–6175 (DOI 10.1021/la800575f)
- (en) G. Graziano, « On the temperature-induced coil to globule transition of poly-N-isopropylacrylamide in dilute aqueous solutions », Int. J. Biol. Macromol., vol. 27, no 1, , p. 89–97 (DOI 10.1016/S0141-8130(99)00122-1)
- (en) G. Zhang, « Study on conformation change of thermally sensitive linear grafted poly(N-isopropylacrylamide) chains by quartz crystal microbalance », Macromolecules, vol. 37, no 17, , p. 6553–6557 (DOI 10.1021/ma035937+)
- (en) G. Liu & G. Zhang, « Collapse and swelling of thermally sensitive poly(N-isopropylacrylamide) brushes monitored with a quartz crystal microbalance », J. Phys. Chem. B, vol. 109, no 2, , p. 743–747 (DOI 10.1021/jp046903m)
- (en) N. Ishida & S. Biggs, « Direct observation of the phase transition for a poly(N-isopropylacryamide) layer grafted onto a solid surface by afm and QCM-D », Langmuir, vol. 23, no 22, , p. 11083–11088 (DOI 10.1021/la701461b)
- (en) M. Annaka, C. Yahiro, K. Nagase, A. Kikuchi & T. Okano, « Real-time observation of coil-to-globule transition in thermosensitive poly(N-isopropylacrylamide) brushes by quartz crystal microbalance », Polymer, vol. 48, no 19, , p. 5713–5720 (DOI 10.1016/j.polymer.2007.06.067)
- (en) C. Ramkissoon-Ganorkar, A. Gutowska, F. Liu, M. Baudys & S. W. Kim, « Polymer molecular weight alters properties of pH-/temperature-sensitive polymeric beads », Pharm. Res., vol. 16, no 6, , p. 819–827 (DOI 10.1023/A:1018813700535)
- (en) K.N. Plunkett, X. Zhu, J.S. Moore & D.E. Leckband, « PNIPAM chain collapse depends on the molecular weight and grafting density », Langmuir, vol. 22, no 9, , p. 4259–4266 (DOI 10.1021/la0531502)
- (en) Y. Pei, J. Chen, L. Yang, L. Shi, Q. Tao, B. Hui & J. Li, « The effect of pH on the LCST of poly(N-isopropylacrylamide) and poly(N-isopropylacrylamide-co-acrylic acid) », J. Biomater. Sci. Polym. Ed., vol. 15, no 5, , p. 585–594 (DOI 10.1163/156856204323046852)
- (en) G. Zhang & C. Wu, « Reentrant coil-to-globule-to-coil transition of a single linear homopolymer chain in a water/methanol mixture », Physical Review Letters, vol. 86, no 5, , p. 822–825 (DOI 10.1103/PhysRevLett.86.822)
- (en) H.G. Schild & D.A. Tirrell, « Microcalorimetric detection of lower critical solution temperatures in aqueous polymer solutions », J. Phys. Chem., vol. 94, no 10, , p. 4352–4356 (DOI 10.1021/j100373a088)
- (en) F. Eeckman, K. Amighi & A.J. Moës, « Effect of some physiological and non-physiological compounds on the phase transition temperature of thermoresponsive polymers intended for oral controlled-drug delivery », Int. J. Pharm., vol. 222, no 2, , p. 259–270 (DOI 10.1016/S0378-5173(01)00716-5)
- (en) T. G. Park & A. S. Hoffman, « Estimation of temperature-dependent pore size in poly(N-isopropylacrylamide) hydrogel beads », Biotechnol. Prog., vol. 10, no 1, , p. 82–86 (DOI 10.1021/bp00025a010)
- (en) G. Rollason, J.E. Davies & M.V. Sefton, « Preliminary report on cell culture on a thermally reversible copolymer », Biomaterials, vol. 14, no 2, , p. 153–155 (DOI 10.1016/0142-9612(93)90230-Y)
- (en) K. Auditore-Hargreaves, R.L. Houghton, N. Monji, J.H. Priest, A.S. Hoffman & R.C. Nowinski, « Phase-separation immunoassays », Clinical Chemistry, vol. 33, no 9, , p. 1509–1516 (lire en ligne)
- (en) I.C. Barker, J.M.G. Cowie, T.N. Huckerby, D.A. Shaw, I. Soutar & L. Swanson, « Studies of the ”smart” thermoresponsive behavior of copolymers of N-isopropylacrylamide and N,N-dimethylacrylamide in dilute aqueous solution », Macromolecules, vol. 36, no 20, , p. 7765–7770 (DOI 10.1021/ma034250m)
- (en) G. Bokias & Y. Mylonas, « Association of positively charged copolymers based on N-isopropylacrylamide with hydrophobically modified poly(sodium acrylate) in water », Macromolecules, vol. 34, no 4, , p. 885–889 (DOI 10.1021/ma001423o)
- (en) J. Moselhy, X. Y. Wu, R. Nicholov & K. Kodaria, « In vitro studies of the interaction of poly(NIPAM/MAA) nanoparticles with proteins and cells », J. Biomater. Sci. Polym. Ed., vol. 11, no 2, , p. 123–147 (DOI 10.1163/156856200743616)
- (en) S. Mias, J. Sudor & H. Camon, « PNIPAM: a thermo-activated nano-material for use in optical devices », Microsystem Technologies, vol. 14, nos 4–5, , p. 691–695 (DOI 10.1007/s00542-007-0454-6)
- (en) J.M. Weissman, H.B. Sunkara, A.S. Tse & S.A. Asher, « Thermally switchable periodicities and diffraction from mesoscopically ordered materials », Science, vol. 274, no 5289, , p. 959–960 (DOI 10.1126/science.274.5289.959)
- (en) L. Klouda & A.G. Mikos, « Thermoresponsive hydrogels in biomedical applications », Eur. J. Pharm. Biopharm., vol. 68, no 1, , p. 34–45 (DOI 10.1016/j.ejpb.2007.02.025)
- (en) N. Monji & A. S. Hoffman, « A novel immunoassay system and bioseparation process based on thermal phase separating polymers », Appl. Biochem. Biotechnol., vol. 14, no 2, , p. 107–120 (DOI 10.1007/BF02798429)
- (en) N. Monji, C. A. Cole, M. Tam, L. Goldstein & R. C. Nowinski, « Application of a thermally-reversible polymer-antibody conjugate in a novel membrane-based immunoassay », Biochem. Biophys. Res. Commun., vol. 172, no 2, , p. 652–660 (DOI 10.1016/0006-291X(90)90724-2)
- (en) N. Monji, C. A. Cole & A. S. Hoffman, « Activated, n-substituted acrylamide polymers for antibody coupling: application to a novel membrane-based immunoassay », J. Biomater. Sci. Polym. Ed., vol. 5, no 5, , p. 407–420 (DOI 10.1163/156856294X00112)
- (en) I.Y. Galaev & B. Mattiasson, « Thermoreactive water-soluble polymers, nonionic surfactants, and hydrogels as reagents in biotechnology », Enzyme Microb. Technol., vol. 15, no 5, , p. 354–366 (DOI 10.1016/0141-0229(93)90122-I)
- (en) Y.G. Takei, M. Matsukata, T. Aoki, K. Sanui, N. Ogata, A. Kikuchi, Y. Sakurai & T. Okano, « Temperature-responsive bioconjugates. 3. Antibody-poly(N-isopropylacrylamide) conjugates for temperature-modulated precipitations and affinity bioseparations », Bioconjug. Chem., vol. 5, no 6, , p. 577–582 (DOI 10.1021/bc00030a013)
- (en) A. Kumar, P.-O. Wahlund, C. Kepka, I.Y. Galaev & B. Mattiasson, « Purification of histidine-tagged single-chain Fv-antibody fragments by metal chelate affinity precipitation using thermoresponsive copolymers », Biotechnol. Bioeng., vol. 84, no 4, , p. 494–503 (DOI 10.1002/bit.10810)
- A. Kumar, I.Y. Galaev, B. Mattiasson et Michael Zachariou (dir.), Affinity Chromatography: Methods and Protocols, vol. 421, Humana Press, , 348 p. (ISBN 978-1-58829-659-7, présentation en ligne), « Affinity precipitation of proteins using metal chelates », p. 37–52
- (en) J.P. Chen et A.S. Hoffman, « Polymer-protein conjugates. II. Affinity precipitation separation of human immunogammaglobulin by a poly(N-isopropylacrylamide)-protein A conjugate », Biomaterials, vol. 11, no 9, , p. 631–634 (DOI 10.1016/0142-9612(90)90020-Q)
- (en) B. Mattiasson, A. Kumar et I.Y. Galaev, « Affinity precipitation of proteins: design criteria for an efficient polymer », J. Mol. Recognit., vol. 11, nos 1–6, , p. 211–216 (DOI 10.1002/(SICI)1099-1352(199812)11:1/6<211::AID-JMR425>3.0.CO;2-Y)
- (en) D.C. Roepke, S.M. Goyal, C.J. Kelleher, D.A. Halvorson, A.J. Abraham, R.F. Freitas & E.L. Cussler, « Use of temperature-sensitive gel for concentration of influenza virus from infected allantoic fluids », J. Virol. Methods, vol. 15, no 1, , p. 25–31 (DOI 10.1016/0166-0934(87)90045-0)
- (en) S. Anastase-Ravion, Z. Ding, A. Pellé, A.S. Hoffman & D. Letourneur, « New antibody purification procedure using a thermally responsive poly(N-isopropylacrylamide)-dextran derivative conjugate », J. Chromatogr. B Biomed. Sci. Appl., vol. 761, no 2, , p. 247–254 (DOI 10.1016/S0378-4347(01)00336-X)
- (en) Y.H. Bae, T. Okano & S.W. Kim, « ”On-off” thermocontrol of solute transport. II. Solute release from thermosensitive hydrogels », Pharm. Res., vol. 8, no 5, , p. 624–628 (DOI 10.1023/A:1015860824953)
- (en) R. Yoshida, K. Sakai, T. Okano & Y. Sakurai, « Surface-modulated skin layers of thermal responsive hydrogels as on-off switches: II. Drug permeation », J. Biomater. Sci. Polym. Ed., vol. 3, no 3, , p. 243–252 (DOI 10.1163/156856292X00150)
- (en) H. Ichikawa & Y. Fukumori, « A novel positively thermosensitive controlled-release microcapsule with membrane of nano-sized poly(n-isopropylacrylamide) gel dispersed in ethylcellulose matrix », J. Control. Release, vol. 63, nos 1–2, , p. 107–119 (DOI 10.1016/S0168-3659(99)00181-9)
- (en) A. Chilkoti, M.R. Dreher, D.E. Meyer & D. Raucher, « Targeted drug delivery by thermally responsive polymers », Adv. Drug. Deliv. Rev., vol. 54, no 5, , p. 613–630 (DOI 10.1016/S0169-409X(02)00041-8)
- (en) A. Gutowska, Y. H. Bae, H. Jacobs, F. Mohammad, D. Mix, J. Feijen & S.W. Kim, « Heparin release from thermosensitive polymer coatings: in vivo studies », J. Biomed. Mater. Res., vol. 29, no 7, , p. 811–821 (DOI 10.1002/jbm.820290705)
- (en) S.Y. Lin, K.S. Chen & L. Run-Chu, « Design and evaluation of drug-loaded wound dressing having thermoresponsive, adhesive, absorptive and easy peeling properties », Biomaterials, vol. 22, no 22, , p. 2999–3004 (DOI 10.1016/S0142-9612(01)00046-1)
- (en) F. Eeckman, A.J. Moës & K. Amighi, « Evaluation of a new controlled-drug delivery concept based on the use of thermoresponsive polymers », Int. J. Pharm., vol. 241, no 1, , p. 113–125 (DOI 10.1016/S0378-5173(02)00198-9)
- (en) N. Bertrand, J.G. Fleischer, K.M. Wasan, J.C. Leroux, « Pharmacokinetics and biodistribution of N-isopropylacrylamide copolymers for the design of pH-sensitive liposomes », Biomaterials, vol. 30, no 13, , p. 2598–2605 (DOI 10.1016/j.biomaterials.2008.12.082)
- (en) A. Mizutani, A. Kikuchi, M. Yamato, H. Kanazawa & T. Okano, « Preparation of thermoresponsive polymer brush surfaces and their interaction with cells », Biomaterials, vol. 29, no 13, , p. 2073–2081 (DOI 10.1016/j.biomaterials.2008.01.004)
- (en) Y. Hou, A.R. Matthews, A.M. Smitherman, A.S. Bulick, M.S. Hahn, H. Hou, A. Han & M.A. Grunlan, « Thermoresponsive nanocomposite hydrogels with cell-releasing behavior », Biomaterials, vol. 29, no 22, , p. 3175–3184 (DOI 10.1016/j.biomaterials.2008.04.024)
- (en) T. Takezawa, Y. Mori & K. Yoshizato, « Cell culture on a thermo-responsive polymer surface », Biotechnology (N. Y.), vol. 8, no 9, , p. 854–856 (DOI 10.1038/nbt0990-854)
- (en) A. Kushida, M. Yamato, C. Konno, A. Kikuchi, Y. Sakurai & T. Okano, « Temperature-responsive culture dishes allow nonenzymatic harvest of differentiated madin-darby canine kidney (MDCK) cell sheets », J. Biomed. Mater. Res., vol. 51, no 2, , p. 216–223 (DOI 10.1002/(SICI)1097-4636(200008)51:2<216::AID-JBM10>3.0.CO;2-K)
- (en) Y.H. An, D. Webb, A. Gutowska, V.A. Mironov & R.J. Friedman, « Regaining chondrocyte phenotype in thermosensitive gel culture », Anat. Rec. A, vol. 263, no 4, , p. 336–341 (DOI 10.1002/ar.1114)
- (en) T. Okano, N. Yamada, H. Sakai & Y. Sakurai, « A novel recovery system for cultured cells using plasma-treated polystyrene dishes grafted with poly(N-isopropylacrylamide) », J. Biomed. Mater. Res., vol. 27, no 10, , p. 1243–1251 (DOI 10.1002/jbm.820271005)
- (en) H.A. von Recum, T. Okano, S.W. Kim et P.S. Bernstein, « Maintenance of retinoid metabolism in human retinal pigment epithelium cell culture », Exp. Eye Res., vol. 69, no 1, , p. 97–107 (DOI 10.1006/exer.1999.0682)
- (en) M. Yamato, O. H. Kwon, M. Hirose, A. Kikuchi & T. Okano, « Novel patterned cell coculture utilizing thermally responsive grafted polymer surfaces », J. Biomed. Mater. Res., vol. 55, no 1, , p. 137–140 (DOI 10.1002/1097-4636(200104)55:1<137::AID-JBM180>3.0.CO;2-L)
- (en) T. Aoki, Y. Nagao, E. Terada, K. Sanui, N. Ogata, N. Yamada, Y. Sakurai, K. Kataoka et T. Okano, « Endothelial cell differentiation into capillary structures by copolymer surfaces with phenylboronic acid groups », J. Biomater. Sci. Polym. Ed., vol. 7, no 7, , p. 539–550 (DOI 10.1163/156856295X00463)
- (en) H.A. von Recum, S.W. Kim, A. Kikuchi, M. Okuhara, Y. Sakurai & T. Okano, « Novel thermally reversible hydrogel as detachable cell culture substrate », J. Biomed. Mater. Res., vol. 40, no 4, , p. 631–639 (DOI 10.1002/(SICI)1097-4636(19980615)40:4<631::AID-JBM15>3.0.CO;2-I)
- (en) M.T. Moran, W.M. Carroll, A. Gorelov & Y. Rochev, « Intact endothelial cell sheet harvesting from thermoresponsive surfaces coated with cell adhesion promoters », J. R. Soc. Interface, vol. 4, no 17, , p. 1151–1157 (DOI 10.1098/rsif.2007.1023)
- (en) T. Okano, N. Yamada, M. Okuhara, H. Sakai & Y. Sakurai, « Mechanism of cell detachment from temperature-modulated, hydrophilic-hydrophobic polymer surfaces », Biomaterials, vol. 16, no 4, , p. 297–303 (DOI 10.1016/0142-9612(95)93257-E)
- (en) M. Maeda, C. Nishimura, D. Umeno & M. Takagi, « Psoralen-containing vinyl monomer for conjugation of double-helical DNA with vinyl polymers », Bioconjug. Chem., vol. 5, no 6, , p. 527–531 (DOI 10.1021/bc00030a007)
- (en) D. Umeno, M. Kawasaki et M. Maeda, « Water-soluble conjugate of double-stranded DNA and poly(N-isopropylacrylamide) for one-pot affinity precipitation separation of DNA-binding proteins », Bioconjug. Chem., vol. 9, no 6, , p. 719–724 (DOI 10.1021/bc980019f)
- (en) W.L. Hinrichs, N.M. Schuurmans-Nieuwenbroek, P. van de Wetering et W.E. Hennink, « Thermosensitive polymers as carriers for DNA delivery », J. Control. Release, vol. 60, nos 2–3, , p. 249–259 (DOI 10.1016/S0168-3659(99)00075-9)
- (en) M. Kurisawa, M. Yokoyama et T. Okano, « Gene expression control by temperature with thermo-responsive polymeric gene carriers », J. Control. Release, vol. 69, no 1, , p. 127–137 (DOI 10.1016/S0168-3659(00)00297-2)
- (en) T.G. Park et A.S. Hoffman, « Synthesis and characterization of a soluble, temperature-sensitive polymer-conjugated enzyme », J. Biomater. Sci. Polym. Ed., vol. 4, no 5, , p. 493–504 (DOI 10.1163/156856293X00159)
- (en) Z. Ding, G. Chen et A.S. Hoffman, « Synthesis and purification of thermally sensitive oligomer-enzyme conjugates of poly(N-isopropylacrylamide)-trypsin », Bioconjug. Chem., vol. 7, no 1, , p. 121–126 (DOI 10.1021/bc950087r)
- (en) Z. Ding, G. Chen et A.S. Hoffman, « Unusual properties of thermally sensitive oligomer-enzyme conjugates of poly(N-isopropylacrylamide)-trypsin », J. Biomed. Mater. Res. A, vol. 39, no 3, , p. 498–505 (DOI 10.1002/(SICI)1097-4636(19980305)39:3<498::AID-JBM22>3.0.CO;2-5)
- (en) G. Chen et A.S. Hoffman, « Synthesis of carboxylated poly(nipaam) oligomers and their application to form thermo-reversible polymer-enzyme conjugates », J. Biomater. Sci. Polym. Ed., vol. 5, no 4, , p. 371–382 (DOI 10.1163/156856294X00086)
- L.V. Sigolaeva, N.L. Eremeev et N.F. Kazanskaia, « Anomalous temperature dependence of the activity of immobilized alpha-chymotrypsin preparations », Bioorg. Khim., vol. 20, no 3, , p. 268–273
- (en) J.P. Chen, H.J. Yang et A.S. Hoffman, « Polymer-protein conjugates. I. Effect of protein conjugation on the cloud point of poly(N-isopropylacrylamide) », Biomaterials, vol. 11, no 9, , p. 625–630 (DOI 10.1016/0142-9612(90)90019-M)
- (en) P.S. Stayton, T. Shimoboji, C. Long, A. Chilkoti, G. Chen, J.M. Harris et A.S. Hoffman, « Control of protein-ligand recognition using a stimuli-responsive polymer », Nature, vol. 378, no 6556, , p. 472–474 (DOI 10.1038/378472a0)
- (en) Z. Ding, C.J. Long, Y. Hayashi, E.V. Bulmus, A.S. Hoffman et P.S. Stayton, « Temperature control of biotin binding and release with a streptavidin-poly(N-isopropylacrylamide) site-specific conjugate », Bioconjug. Chem., vol. 10, no 3, , p. 395–400 (DOI 10.1021/bc980108s)
- (en) S. Carter, S. Rimmer, R. Rutkaite, L. Swanson, J.P.A. Fairclough, A. Sturdy et M. Webb, « Highly branched poly(N-isopropylacrylamide) for use in protein purification », Biomacromolecules, vol. 7, no 4, , p. 1124–1130 (DOI 10.1021/bm050929h)
- (en) D.L. Huber, R.P. Manginell, M.A. Samara, B.-I. Kim et B.C. Bunker, « Programmed adsorption and release of proteins in a microfluidic device », Science, vol. 301, no 5631, , p. 352–354 (DOI 10.1126/science.1080759)
- (en) D.O.H. Teare, D.C. Barwick, W.C.E. Schofield, R.P. Garrod, A. Beeby et J.P.S. Badyal, « Functionalization of solid surfaces with thermoresponsive protein-resistant films », J. Phys. Chem. B, vol. 109, no 47, , p. 22407–22412 (DOI 10.1021/jp052869f)
- (en) M.D. Kurkuri, M.R. Nussio, A. Deslandes et N.H. Voelcker, « Thermosensitive copolymer coatings with enhanced wettability switching », Langmuir, vol. 24, no 8, , p. 4238–4244 (DOI 10.1021/la703668s)
- (en) A.E. Ivanov, J. Ekeroth, L. Nilsson, B. Mattiasson, B. Bergenståhl et I.Y. Galaev, « Variations of wettability and protein adsorption on solid siliceous carriers grafted with poly(N-isopropylacrylamide) », J. Colloid. Interface Sci., vol. 296, no 2, , p. 538–544 (DOI 10.1016/j.jcis.2005.09.064)
- (en) Y. Matsumaru, A. Hyodo, T. Nose, S. Ito, T. Hirano et S. Ohashi, « Application of thermosensitive polymers as a new embolic material for intravascular neurosurgery », J. Biomater. Sci. Polym. Ed., vol. 7, no 9, , p. 795–804 (DOI 10.1163/156856296X00138)
- (en) M. Andersson, A. Axelsson et G. Zacchi, « Diffusion of glucose and insulin in a swelling N-isopropylacrylamide gel », Int. J. Pharm., vol. 157, no 2, , p. 199–208 (DOI 10.1016/S0378-5173(97)00243-3)
- (en) H. Kanazawa, K. Yamamoto, Y. Kashiwase, Y. Matsushima, N. Takai, A. Kikuchi, Y. Sakurai et T. Okano, « Analysis of peptides and proteins by temperature-responsive chromatographic system using N-isopropylacrylamide polymer-modified columns », J. Pharm. Biomed. Anal., vol. 15, nos 9–10, , p. 1545–1550 (DOI 10.1016/S0731-7085(96)02004-3)
- (en) H. Kanazawa, T. Sunamoto, Y. Matsushima, A. Kikuchi et T. Okano, « Temperature-responsive chromatographic separation of amino acid phenylthiohydantions using aqueous media as the mobile phase », Analytical Chemistry, vol. 72, no 24, , p. 5961–5966 (DOI 10.1021/ac0004658)
- (en) H. Lakhiari, T. Okano, N. Nurdin, C. Luthi, P. Descouts, D. Muller et J. Jozefonvicz, « Temperature-responsive size-exclusion chromatography using poly(N-isopropylacrylamide) grafted silica », Biochim. Biophys. Acta, vol. 1379, no 3, , p. 303–313 (DOI 10.1016/S0304-4165(97)00110-4)








