| Tétracyanoéthylène | |
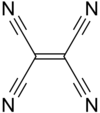  Structure du TCNE |
|
| Identification | |
|---|---|
| Nom UICPA | éthène-1,1,2,2-tétracarbonitrile |
| Synonymes |
éthylène tétracarbonitrile |
| No CAS | |
| No ECHA | 100.010.527 |
| No CE | 211-578-0 |
| PubChem | 12635 |
| SMILES | |
| InChI | |
| Apparence | solide jaune |
| Propriétés chimiques | |
| Formule | C6N4 |
| Masse molaire[1] | 128,091 ± 0,005 6 g/mol C 56,26 %, N 43,74 %, |
| Propriétés physiques | |
| T° fusion | 198,85 °C [2] |
| T° ébullition | 223,05 °C [2] |
| Thermochimie | |
| ΔfH0gaz | 688,1 kJ·mol-1 [2] |
| ΔfH0solide | 607,1 kJ·mol-1 [2] |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
Le tétracyanoéthylène, généralement abrégé en TCNE, également appelé éthylène tétracarbonitrile, est un composé chimique de formule (N≡C)2C=C(C≡N)2. Il se présente sous forme d'un solide jaune semiconducteur de type n (accepteur d'électrons) qui peut donner des sels de Bechgaard. Il s'hydrolyse en libérant du cyanure d'hydrogène HCN en présence d'humidité et doit donc être manipulé avec les précautions qui s'imposent.
Les groupes –C≡N ont des orbitales π* de basse énergie, de sorte que quatre groupes cyano conjugués avec la double liaison centrale constituent un système accepteur d'électrons. Le traitement du TCNE avec des iodures donne ainsi l'anion correspondant :
- C2(CN)4 + I − → [C2(CN)4] − + ½ I2
Compte tenu de son caractère d'accepteur d'électrons et de sa configuration plane, le TCNE a été utilisé pour préparer de nombreuses structures supraconductrices organiques en formant des complexes à transfert de charge.
Articles liés
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Tetracyanoethylene », sur NIST/WebBook, consulté le 17 juin 2009








