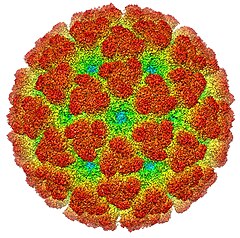
Alphavirus chikungunya
| Groupe | Groupe IV |
|---|---|
| Famille | Togaviridae |
| Genre | Alphavirus |
Le virus du chikungunya, dont le nom scientifique est Alphavirus chikungunya, est un virus à ARN monocaténaire de polarité positive (groupe IV de la classification Baltimore) appartenant au genre Alphavirus de la famille des Togaviridae. Apparenté au virus Ross River (en), au virus o'nyong-nyong et au virus de la forêt de Semliki[3], il s'agit d'un arbovirus transmis par des moustiques du genre Aedes, notamment les espèces Aedes aegypti et Aedes albopictus (« moustique-tigre »). Ces vecteurs transmettent le virus via la salive à l'humain et aux animaux sauvages, et l'acquièrent lors d'un repas sanguin sur un hôte infecté[4]. Chez l'humain, il provoque une maladie tropicale, le chikungunya.
Description
Le génome de ce virus est long d'environ 11,7 kilobases et comporte deux gènes[5] : l'un code une polyprotéine structurelle de 1 288 résidus d'acides aminés et l'autre code une polyprotéine non structurelle de 2 474 résidus. Ces deux polyprotéines sont les précurseurs de plusieurs protéines virales : la polyprotéine structurelle est clivée en protéine C de capside, glycoprotéines E1, E2 et E3 de l'enveloppe virale, et protéine 6K ; la polyprotéine non structurelle est clivée en protéines nsP1 à nsP4, cette dernière ayant probablement une fonction d'ARN polymérase ARN-dépendante, intervenant par conséquent dans la réplication virale[6]. Il est possible qu'une mutation d'un gène codant une protéine de l'enveloppe virale puisse favoriser l'infection par le moustique vecteur et expliquer en partie la propagation particulière de ce virus dans les années 2000[7]. De plus, la spécificité du vecteur est déterminée par la protéine virale non structurale nsP3[4].
Cycle viral
Une fois aspiré par le vecteur dans ses pièces buccales, le virus est amené dans l’intestin moyen où il effectue sa réplication[4]. Après attachement des glycoprotéines virales aux récepteurs cellulaires, le virus entre dans l’épithélium de l’intestin par un mécanisme d’endocytose clathrine-dépendante. Grâce à la glycoprotéine E1, l’enveloppe virale fusionne avec celle de l’endosome cellulaire permettant ainsi la libération de la nucléocapside virale puis de l’ARN viral de polarité positive dans le cytoplasme. Sa traduction en polyprotéine non structurale se produit, ainsi que les clivages de cette polyprotéine en protéines non structurales nécessaires à la réplication qui a lieu dans des usines virales à la surface des endosomes. La réplicase virale nsP4 permet la réplication de l’ARN viral, ainsi que par la suite la génération d’un ARN subgénomique. Cet ARN subgénomique permet la traduction d’une polyprotéine structurale qui est clivée en protéines structurales virales dont les glycoprotéines E1, E2 et E3, ainsi que la protéine de capside. L’encapsidation des nouveaux génomes viraux se produit dans le cytoplasme et se poursuit avec le bourgeonnement au travers de la membrane plasmique du lysosome et de l’endosome qui permet l’acquisition de l’enveloppe virale[8],[9],[10].
À partir de ce stade, deux mécanismes sont envisagés pour expliquer la dissémination du virus vers les organes secondaires. Le premier mécanisme serait que les virions néoformés s’accumulent au niveau de la lame basale de l’intestin où un remodelage médié par les collagénases se produit. Le deuxième serait l’entrée des virions dans le système des cellules trachéales entourant l’intestin. Dans tous les cas, trois à sept jours post-infection, les virions rejoignent les glandes salivaires, et en particulier les cellules acineuses, sans causer d’effet cytopathique, afin de pouvoir par la suite être éjectés dans la salive de l’hôte[4].
Dans de rares cas, une infection ainsi qu’une réplication seraient possibles dans les ailes et dans les ovaires. Par contre une transmission horizontale par les œufs n’a pas été prouvé[11].
Le large spectre d’hôte et le large tropisme du virus étudié sont expliqués par la présence de la glycoprotéine E2 facilitant les liaisons aux cellules, ainsi que de récepteurs cellulaires putatifs non identifiés mais exprimés chez plusieurs espèces et types cellulaires qui permettraient ainsi l’entrée du virus[4].
Une coinfection du CHIKV avec d’autres virus du même genre, comme le virus Zika ou le virus Dengue, est possible sans effet de compétition[4].
Notes et références
- (en) Siyang Sun, Ye Xiang, Wataru Akahata, Heather Holdaway, Pankaj Pal, Xinzheng Zhang, Michael S. Diamond, Gary J. Nabel et Michael G. Rossmann1, « Structural analyses at pseudo atomic resolution of Chikungunya virus and antibodies show mechanisms of neutralization », eLife, vol. 2, , article no e00435 (PMID 23577234, PMCID 3614025, DOI 10.7554/eLife.00435, lire en ligne)
- (en) « Virus Taxonomy: 2023 Release », ICTV, (consulté le ).
- (en) Ann M. Powers, Aaron C. Brault, Yukio Shirako, Ellen G. Strauss, WenLi Kang, James H. Strauss et Scott C. Weaver, « Evolutionary Relationships and Systematics of the Alphaviruses », Journal of Virology, vol. 75, no 21, , p. 10118-10131 (PMID 11581380, PMCID 114586, DOI 10.1128/JVI.75.21.10118-10131.2001, lire en ligne)
- (en) Giulia Matusali, Francesca Colavita, Licia Bordi, Eleonora Lalle, Giuseppe Ippolito, Maria R Capobianchi et Concetta Castilletti, « Tropism of the Chikungunya Virus », Review, (PMID 30791607, PMCID PMC6410217, DOI 10.3390/v11020175, lire en ligne
 )
)
- (en) Scott C. Weaver, Jorge E. Osorio, Jill A. Livengood, Rubing Chen et Dan T. Stinchcomb, « Chikungunya virus and prospects for a vaccine », Expert Review of Vaccines, vol. 11, no 9, , p. 1087-1101 (PMID 23151166, PMCID 3562718, DOI 10.1586/erv.12.84, lire en ligne)
- (en) Isabelle Schuffenecker, Isabelle Iteman, Alain Michault, Séverine Murri, Lionel Frangeul, Marie-Christine Vaney, Rachel Lavenir, Nathalie Pardigon, Jean-Marc Reynes, François Pettinelli, Leon Biscornet, Laure Diancourt, Stéphanie Michel, Stéphane Duquerroy, Ghislaine Guigon, Marie-Pascale Frenkiel, Anne-Claire Bréhin, Nadège Cubito, Philippe Desprès, Frank Kunst, Félix A Rey, Hervé Zeller et Sylvain Brisse, « Genome Microevolution of Chikungunya Viruses Causing the Indian Ocean Outbreak », PLoS Medicine, vol. 3, no 7, , article no e263 (PMID 16700631, PMCID 1463904, DOI 10.1371/journal.pmed.0030263, lire en ligne)
- (en) Konstantin A Tsetsarkin, Dana L Vanlandingham, Charles E McGee et Stephen Higgs, « A Single Mutation in Chikungunya Virus Affects Vector Specificity and Epidemic Potential », PLoS Pathogens, vol. 3, no 12, , article no e201 (PMID 18069894, PMCID 2134949, DOI 10.1371/journal.ppat.0030201, lire en ligne)
- (en) Bharat Bhusan Subudhi, Soma Chattopadhyay, Priyadarsee Mishra et Abhishek Kumar, « Current Strategies for Inhibition of Chikungunya Infection », Viruses, 10e série, vol. 235, (PMID 29751486, PMCID PMC5977228, DOI 10.3390/v10050235, lire en ligne
 )
)
- Maxime Solignat, Bernard Gay, Stephen Higgs et Laurence Briant, « Replication cycle of chikungunya: A re-emerging arbovirus », Virology, vol. 393, no 2, , p. 183–197 (ISSN 0042-6822, PMID 19732931, PMCID 2915564, DOI 10.1016/j.virol.2009.07.024, lire en ligne, consulté le )
- Amelia R. I. Lindsey, Tamanash Bhattacharya, Irene L. G. Newton et Richard W. Hardy, « Conflict in the Intracellular Lives of Endosymbionts and Viruses: A Mechanistic Look at Wolbachia-Mediated Pathogen-blocking », Viruses, vol. 10, no 4, , p. 141 (ISSN 1999-4915, PMID 29561780, PMCID 5923435, DOI 10.3390/v10040141, lire en ligne, consulté le )
- (en) Luciano A. Moreira, Iñaki Iturbe-Ormaetxe, Jason A. Jeffery et Guangjin Lu, « A Wolbachia Symbiont in Aedes aegypti Limits Infection with Dengue, Chikungunya, and Plasmodium », Cell, vol. 139, no 7, , p. 1268–1278 (DOI 10.1016/j.cell.2009.11.042, lire en ligne, consulté le )
Bibliographie
- (en) Joceline Lega et Heidi E. Brown, « Data-driven outbreak forecasting with a simple nonlinear growth model », Epidemics, vol. 17, , p. 19–26 (PMID 27770752, PMCID PMC5159251, DOI 10.1016/j.epidem.2016.10.002, lire en ligne, consulté le ).