Le franchissement de la barrière hémato-encéphalique concerne l'introduction des médicaments dans le système nerveux central. C'est une barrière dynamique, qui contrôle par des processus d'influx (entrée) et d'efflux (sortie) quelles molécules présentes dans le sang à partir des aliments, médicaments, drogues, xénobiotiques pourront passer dans le milieu liquide qui baigne le cerveau, le liquide cérébrospinal[1]. Environ 98 % des médicaments envisageables pour soigner le système nerveux central, et tout particulièrement le cerveau, ne la franchissent pas[2].
Présentation générale

Peu de substances passent spontanément avec une certaine efficacité : ce sont des médicaments composés de petites molécules lipophiles, efficaces pour certains troubles affectifs comme la dépression, pour l’épilepsie ou pour les douleurs chroniques[3],[4].
Mais il n'existe aucun médicament contre les maladies neurodégénératives comme la maladie d'Alzheimer, la chorée de Huntington ou la sclérose latérale amyotrophique[2]. Pour les tumeurs du cerveau, les accidents vasculaires cérébraux, les lésions de la moelle spinale ou les enfoncements du crâne, on ne connaît aucune thérapeutique médicamenteuse. Dans les syndromes survenant chez l'enfant comme l'autisme, les maladies lysosomales, le syndrome de l'X fragile ou l'ataxie, la barrière hémato-encéphalique présente un obstacle qui empêche jusqu'à maintenant les propositions de thérapie médicamenteuse[5]. Même pour des maladies telles que la sclérose en plaques, la progression de la maladie dans le système nerveux central ne peut pas être arrêtée, car les médicaments administrés n'agissent que sur les nerfs périphériques.
En principe, beaucoup de ces maladies pourraient être traitées par des médicaments, par exemple sur la base d'enzymes, de gènes ou de protéines fabriquées par génie génétique – si l’on pouvait leur faire franchir la barrière hémato-encéphalique. Mais une thérapie n'est possible que si la substance peut pénétrer en concentration thérapeutiquement efficace sur la cible – ici le système nerveux central[6]. C'est pourquoi on recherche intensivement depuis des décennies des méthodes pour permettre le transport de médicaments par contournement, ou franchissement – dans l’idéal sélectif – de la barrière hémato-encéphalique[7],[8]. Toute une série de stratégies pour franchir la barrière hémato-encéphalique ont été mises au point, ou sont en cours de mise au point[9],[10].
Franchissement mécanique : injection intrathécale ou intraventriculaire
La première idée pour transporter un médicament dans le système nerveux central en contournant la barrière hémato-encéphalique est de l’injecter directement dans le liquide cérébrospinal sous les méninges (injection intrathécale) ou directement dans les ventricules cérébraux (injection intraventriculaire)[11]. Le médicament atteint alors son but sans obstacle. On utilise ce procédé par exemple pour la chimiothérapie intrathécale[12],[13], en particulier avec méthotrexate, cytarabine et cortisol, particulièrement chez les patients souffrant de leucémie lymphoblastique aiguë et de lymphomes agressifs[14]. Ces trois substances sont injectées ensemble dans le liquide cérébrospinal en chimiothérapie intrathécale triple en cas de lymphome agressif[15],[16].
L'administration intrathécale de médicaments est significativement plus délicate et pour beaucoup de patients plus désagréable que la simple injection intraveineuse. En outre, il existe pour l'opérateur dans ce type d'intervention des exigences d'hygiène et d'habileté technique bien plus élevées, en raison des risques substantiels d'infection ou de blessure. Par l'injection de formes retard des médicaments, on peut espacer dans le temps les injections, par exemple toutes les deux semaines[16]. Il est encore plus pratique d'utiliser un réservoir Ommaya ou Rickham, implanté sous la peau. De manière semblable, il existe des pompes à médicaments implantables[17]. Dans des états de souffrance très aiguë, cette méthode peut être utilisée pour administrer des doses convenables de morphine[18],[19]. On peut également utiliser dans ce genre une pompe à baclofène pour le traitement intrathécal de patients spastiques, par exemple atteints de sclérose en plaques[20],[21],[22]. La méthode a été utilisée pour la première fois en 1984[23] et est maintenant établie[24],[25].
La forme galénique des substances médicamenteuses administrées par voie intrathécale est en général spécialement adaptée à cette voie. Par exemple, elle ne doit pas contenir de bactéricides, ni toute une série de substances adjuvantes usuellement ajoutées dans les médicaments pour injections intraveineuses[26].
Pour quelques maladies, l'injection intrathécale ou intraventriculaire permet une thérapie efficace. Mais pour le traitement des tumeurs du cerveau, ces deux méthodes de franchissement de la barrière hémato-encéphalique n'est pas appropriée, en raison de la diffusion des médicaments limitée à quelques millimètres dans le parenchyme cérébral[27],[28],[29].
Une brèche expérimentale et utilisable en thérapeutique dans la barrière hémato-encéphalique est formée par les nerfs crâniens pénétrant dans le cerveau. Il a ainsi pu être démontré que par exemple des neurotrophines, des neuropeptides, de l'insuline, des cytokines et même de l'ADN, administrés par le nez, peuvent pénétrer le long des nerfs olfactifs dans le système nerveux central[30]. On a même pu faire entrer avec succès des cellules souches dans le cerveau par cette voie[31].
Modulation des interactions entre molécules et cellules endothéliales
L'intégrité de la barrière hémato-encéphalique est une condition de vie ou de mort pour tous les vertébrés. Pour beaucoup de médicaments qui doivent exercer leur action à l'extérieur du système nerveux central, l'imperméabilité de la barrière hémato-encéphalique est un critère important pour l'autorisation de mise sur le marché, afin d'exclure tout effet secondaire éventuellement important qui pourrait se produire sur le système nerveux central, en particulier dans le cas de prise du médicament pour une longue durée. À l'opposé, la barrière hémato-encéphalique représente un obstacle encore infranchissable pour beaucoup de composés que l'on pourrait souhaiter utiliser pour soigner les maladies neurologiques[32],[5]. On peut envisager d'agir soit chimiquement sur les molécules du médicament, soit en général par voie physique sur les propriétés de la barrière hémato-encéphalique durant le traitement, des moyens visant à desserrer les jonctions serrées assurant l'étanchéité entre cellules endothéliales voisines.
Lipophilisation
-
Formule structurale de la morphine.
-
La codéine (3-méthylmorphine) est un peu plus lipophile que la morphine par sa méthylation.
-
L'héroïne est encore plus lipophile que la codéine, à cause de ses deux groupes acétyle.
Le pouvoir de diffusion d'une molécule à travers les endothéliums de la barrière hémato-encéphalique est tout d'abord déterminé par sa lipophilie et sa taille. En ajoutant à une molécule des radicaux lipophiles, on peut améliorer sa capacité à pénétrer dans le cerveau[33]. Un exemple classique est la diacétylation de la morphine, une substance naturelle, en diacétyl-morphine ou héroïne. L'héroïne (logP = 1,12) pénètre 25 fois plus facilement dans le cerveau que la morphine (logP = 0,2. Voir Table 1[34]). Des résultats semblables sont obtenus pour l’indice d'absorption cérébrale (BUI selon le sigle anglais) obtenus avec morphine, codéine ou héroïne marquées radioactivement et injectées dans la carotide. Pour la morphine, le BUI n'est pas mesurable, pour la codéine il est de 24 % et pour l’héroïne de 68 %[35]. Il est à noter que la codéine et l'héroïne sont débarrassées de leurs radicaux superflus dans le cerveau et y agissent sous forme de morphine.
Ce concept de prodrogue peut même conduire à une amélioration de l'accès au cerveau de molécules peptidiques[36].
Mais il ne s'applique pas à des molécules de masse molaire supérieure à 500 Da, car la taille de ces molécules ne leur permet plus de traverser la barrière hémato-encéphalique par diffusion. En outre, la lipophilisation entraîne une dégradation significative de la solubilité de la matière en milieu aqueux. Par voie orale, on ne peut absorber par le tube digestif que des substances dissoutes. La lipophilisation entraîne en outre une pénétration accrue dans des cellules autres que celles du cerveau. Enfin, la lipophilisation est inefficace contre les transporteurs d'efflux qui éliminent de l'endothélium capillaire les substances y qui sont entrées par diffusion.
Utilisation des transporteurs
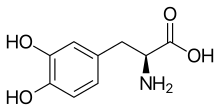

Au sein de l’endothélium des capillaires sanguins, qui forment la barrière hémato-encéphalique, il existe de nombreux systèmes de transport, destinés à approvisionner le cerveau avec des substances pour la plupart hydrophiles. Une idée pour faire entrer des substances actives dans le cerveau consiste à utiliser ces transporteurs. Ceci est fait par exemple dans le cas de la maladie de Parkinson. Dans cette maladie, les patients souffrent d'un manque du neurotransmetteur dopamine. Mais la fourniture de dopamine s'avèrerait sans effet, car la dopamine ne peut passer la barrière hémato-céphalique. Mais si par contre, on administre de la L-Dopa, un acide α-aminé non protéinogène, il est transporté par le transporteur LAT-1 dans le cerveau et là, immédiatement transformé chimiquement en dopamine. Le transporteur LAT-1 appartient à la famille des transporteurs LNAA (sigle anglais de Large Neutral Amino Acid)[37]. Le même mécanisme utilisant des transporteurs LNAA s'applique à l'antiépileptique gabapentine, à l'antihypertenseur α-méthyldopa et aux cytostatiques melphalane et acivicine[36],[2],[38],[39].
Un autre exemple est présent dans la maladie d'Alzheimer où des travaux in vivo indiquent que cibler le récepteur de la transferrine permet l’endocytose massive dans les cellules endothéliales du cerveau formant la barrière hémato-encéphalique[40].
La limite supérieure de masse pour l'utilisation des systèmes de transport existants se situe vers 500 à 600 Da[41].
Vectorisation
Une autre voie pour faire franchir la barrière hémato-encéphalique à un médicament est la vectorisation[42]. Ce principe repose sur l’observation que certaines macromolécules, comme la transferrine[43], la lipoprotéine de basse densité[44] et l’insuline[45], et certains virus comme l'AAV peuvent traverser la barrière hémato-encéphalique par un processus en plusieurs étapes, la transcytose à récepteurs. Des récepteurs spécifiques se trouvent à la surface des cellules endothéliales, vers la lumière du capillaire. Si une macromolécule est reconnue, elle est englobée par la paroi cellulaire, qui se déforme en puits, puis se ferme en une vésicule. Cette vésicule est transportée vers l’autre côté de la cellule, et ouverte pour libérer la macromolécule. Si on lie une molécule active à cette macromolécule, on peut utiliser cette transcytose à récepteurs pour la faire pénétrer dans le cerveau.
Un exemple est celui du récepteur de la transferrine : au moyen d'anticorps monoclonaux dirigés contre lui, on peut l’utiliser pour le transport de médicaments à travers la barrière hémato-encéphalique. Ce récepteur est normalement utilisé pour faire entrer du fer dans le cerveau[46],[47]. Une autre voie possible est le récepteur de l’insuline, également exprimé par la barrière hémato-encéphalique[48]. Il a été possible de faire passer avec succès des peptides, même gros, à travers la barrière hémato-encéphalique à l'aide de ces deux vecteurs, chez des animaux de laboratoire[49]. La vectorisation est un principe très prometteur, spécialement pour des maladies neurodégénératives, pour lesquelles les quantités de médicament à apporter sont minimes[50],[51]. Des cytostatiques, comme la doxorubicine ont également été liés à un anticorps anti-récepteur de la transferrine[52].
Le phénomène de transcytose ne se limite pas à des macromolécules. Bien que le mécanisme exact ne soit pas encore établi, il a pu être montré que de petits peptides et substances de basse masse moléculaire pouvaient entrer dans la cellule et la traverser. Une vectorisation en vue de faire passer de courtes séquences peptidiques est donc possible. On a utilisé comme vecteurs pour des molécules comme la doxorubicine, des dérivés basiques de protégrine, comme Syn-B[53],[54], ou la pénétratine, dérivée d'un facteur de transcription de l’homéodomaine Antennapedia de la drosophile[55].Un autre vecteur peptidique est HIV-TAT (de Human Immunodeficiency Virus Trans-Activator of Transcription), composé de onze acides aminés surtout basiques isolé du domaine de transduction du VIH[56],[51]. Un peptide de propriétés semblables est le transportane, fait de 27 acides aminés (GWTLNSAGYLLGKINLKALAALAKKIL-amide)[57].
Cationisation
Les molécules chargées positivement (cations) peuvent franchir la barrière hémato-encéphalique par transcytose par adsorption[58]. Dans la transcytose par adsorption, des interactions électrostatiques entre la surface de la cellule, chargée négativement par des glycoprotéines et les molécules chargées positivement provoquent leur liaison non spécifique à la surface de la cellule, à la suite de quoi s'ensuit leur capture et leur transport à travers le cytoplasme de l’endothélium[59]. La transcytose cationique à travers la barrière hémato-encéphalique permet une meilleure capacité de transport que la transcytose à récepteurs[60].
La cationisation d'anticorps a été mise en œuvre avec succès dans toute une série de travaux et de champs d'application. Par exemple, pour rendre visibles les plaques de bêta-amyloïde[61],[62], ou pour cibler les mitochondries[63].
Une charge positive est déjà portée par les peptides et les protéines dont le point isoélectrique est basique[51]. Une voie pour améliorer l'entrée dans le cerveau de peptides et protéines non basiques est de les combiner chimiquement avec des polyamines naturels tels que la putrescine, la spermine ou la spermidine[64],[65]. Une alternative est la vectorisation par des peptides basiques tels que Syn-B[58]. On peut aussi utiliser des polyamines synthétiques tels que la polyéthylèneimine pour faciliter le transport de médicaments et d'ADN à travers la barrière hémato-encéphalique[66].
L'effet de la cationisation permet, certes, le passage des substances actives ou diagnostiques par la barrière hémato-encéphalique, mais elle produit simultanément une absorption accrue de la dose administrée par le foie et les reins, avec les effets secondaires possibles.
Nanoparticules
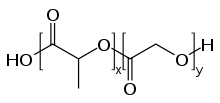


Dans les années 1990, on a établi dans des expériences avec des nanoparticules formées de polymères biocompatibles que ces particules sont dans certaines conditions capables de franchir la barrière hémato-encéphalique. Le diamètre de ces particules va en général de 50 à 300 nm. Les particules de polymère pur, non fonctionnel, ne sont pas en mesure de traverser l'endothélium vers le cerveau. Le transport à récepteurs n'est possible que par une fonctionnalisation spéciale, la plupart du temps avec du polysorbate 80 (monooléate de polyoxyéthylène de sorbitane) ou des poloxamères[67]. Les polymères utilisés pour former le reste de l’enveloppe sont d'habitude de l’acide polylactique (PLA), du copolyacide lactique-glycolique (PLGA) ou du polycyanoacrylate de butyle (PBCA)[68], qui n'ont aucun inconvénient pharmacologique, et sont autorisés pour d'autres usages, comme la suture chirurgicale. Les médicaments inclus dans la nanoparticule peuvent ainsi être transférés dans le cerveau par transcytose à transporteurs[69].
Les conditions essentielles pour la possibilité d'entrer dans le cerveau des nanoparticules est – à part leur taille – un temps de circulation le plus long possible dans le sang et les caractéristiques de surface. La demi-vie plasmatique est d'habitude atteinte par « PEGylation » (liaison avec du PEG), et l'interaction au niveau de l'endothélium par le polysorbate mentionné[70]. Le mécanisme de transport n'est pas encore complètement clarifié. La couverture en polysorbate de la particule conduit apparemment à l'adsorption de l'apolipoprotéine E ou B sur la particule. Alors, la particule apparaît comme du LDL et est reconnue comme telle par le récepteur du LDL, ce qui démarre le processus de transport. Puis soit le médicament est libéré dans l’endothélium, d'où il diffuse vers le cerveau, soit la particule est expulsée en entier vers le cerveau, ce qui termine la transcytose[71].
Le transport par nanoparticules en est actuellement encore au stade de la recherche préclinique. Sur les rats, on a obtenu par cette méthode des résultats très prometteurs pour le traitement de glioblastomes transplantés. Les particules étaient alors chargées de doxorubicine[72]. On a pu ainsi multiplier par un facteur 60 le rythme de transport de la doxorubicine dans le cerveau[73]. La chimiothérapie des tumeurs du cerveau, difficile en raison des difficultés à introduire les médicaments anticancéreux à travers la barrière hémato-encéphalique, est un des buts majeurs de la mise au point de ce système de transport par nanoparticules[74].
En outre, le choix des ligands permet de penser que l'on pourrait cibler des tissus ou des récepteurs spécifiques des nanoparticules[75].
Outre le programme de nanoparticules recouvertes de polymères, on étudie aussi au stade préclinique des nano-liposomes[76],[77] ainsi que des dendrimères[78]. Dans ce contexte, une attention toute particulière est portée sur les risques des nanotechnologies, dans le cadre de la discussion générale à toute la branche[79].
Solvants et tensioactifs
Des composés comme l'éthanol, le diméthylsulfoxyde[80] ou la glycérine injectés en intra-veineux peuvent conduire à une ouverture induite par leur pouvoir solvant de la barrière hémato-encéphalique. Chez des animaux (poussins) la concentration en solvant nécessaire dépasse 1 mg/g[81]. Ces composés perturbent sans doute la fonction de la membrane cellulaire de l'endothélium, ce qui permet le transport de matière par diffusion transcellulaire[5].

Si l'on injecte dans la carotide des acylglycérols à courte chaîne, par exemple, comme l'oxyde de 1-O-Hexyldiglycerol avec des marqueurs, chez des rats ou des souris, la pénétration de ces marqueurs dans le cerveau augmente significativement. De grosses molécules, qui ne passent autrement jamais à travers la barrière hémato-encéphalique, comme le méthotrexate, la vancomycine ou la gentamicine, peuvent diffuser dans le cerveau en présence de l'acylglycérol[82]. Cet effet n'est pas observé en injection intraveineuse de l'acylglycérol. Les glycérols amphiphiles n'ouvrent la barrière hémato-encéphalique qu'entre 5 et 120 min environ[83]. La concentration des acylglycérols se situent dans le domaine du mmol/l. Apparemment, ces composés du genre tensioactif forment avec les substances actives, ou les marqueurs, des structures vésiculaires[84]. Les acylglycérols sont en grande partie non toxiques et insouçonnables sur le plan pharmacologique[85],[86]. Le mécanisme de franchissement de la barrière hémato-encéphalique n'est actuellement pas clair. Il s'agit sans doute d'un transport à travers les jonctions serrées[83].
Le tensioactif laurylsulfate de sodium élève aussi par injection dans la carotide la perméabilité de la barrière hémato-encéphalique[87]. Le laurylsulfate de sodium est un adjuvant pharmacologique qui est utilisé dans la formulation de divers médicaments. L'utilisation de ce genre de mixture peut donc conduire à des résultats inattendus. C'est ainsi que l'utilisation d'un médicament ainsi formulé, avec de l'interleukine IL-2 chez le chat a conduit la barrière hémato-encéphalique à devenir à un degré surprenant perméable au marqueur péroxydase du raifort[88],[81]. Des effets semblables ont aussi été constatés avec l'adjuvant polysorbate 80. Dans ce cas, il suffit chez la souris de doses dans le domaine des 3 mg/kg de poids corporel[89]. La kyotorphine, un dipeptide actif sur le plan neurophysiologique, ne peut pas passer la barrière hémato-encéphalique et montrer son action neurologique. Mais en liaison avec du polysorbate 80, on atteint l'activité neurologique[90],[81].
Inhibition de l'efflux


Beaucoup de molécules sont capables de traverser la barrière hémato-encéphalique, grâce à leur petite taille et aussi à leur lipophilie. Mais après avoir diffusé dans le cytoplasme des cellules endothéliales, elles sont rejetées dans la lumière du capillaire par des pompes à efflux, comme la glycoprotéine P. Une stragégie pour faire entrer malgré tout ces molécules dans le cerveau consiste à paralyser les transporteurs d'efflux. Dans le principe, ceci pourrait se faire par :
- La régulation de l'expression des gènes, dans la phase de la transcription ou la traduction des ARNm ;
- La modification du ciblage vers la membrane après la synthèse du transporteur dans le ribosome ;
- L'incapacitation du transporteur par des inhibiteurs.
Tandis que les deux premières méthodes en sont encore à un degré d'élaboration très précoce, au niveau des cultures de cellules, il y a pour les inhibiteurs d'efflux une riche expérience sur les animaux, et quelques études cliniques chez l'homme[91].
Et maintenant on connaît toute une série de substances qui inhibent les transporteurs d'efflux, particulièrement la glycoprotéine P[92],[93]. Voir la Table 1 de la référence[94].
Les souris auxquelles on a supprimé l'expression du gène MDR1 (knock-out), si bien qu'aucune glycoprotéine P ne soit produite dans l’endothélium, présentent pour un grand nombre de substances une capacité substantiellement plus grande de pénétrer dans le cerveau à travers la barrière hémato-encéphalique. En comparaison avec la souris de type sauvage, le rapport des concentrations cerveau/sang pour les inhibiteurs de protéases du VIH Nelfinavir, Indinavir et Saquinavir sont augmentés par un facteur de 7 à 36[95]. Pour les taxanes paclitaxel et docétaxel, la concentration dans le cerveau s'élève d'un facteur de 7 à 28[96],[97],[98], pour la digoxine d'un facteur 10[99] et pour le vérapamil d'un facteur 8,5[100].
Chez les souris et rats de type sauvage auxquels on a administré des inhibiteurs sélectifs de la glycoprotéine P, comme le valspodar (PSC 833, un dérivé de la ciclosporine), l'élacridar (GF120918) et le zosuquidar (LY335979), on a pu obtenir des résultats comparables[101],[99],[98],[97]. Pour les rats auxquels on a administré de la ciclosporine, la concentration de vérapamil dans le cerveau s'élève d'un facteur 9,6[100],[102].
Le vérapamil, un médicament autorisé en tant qu'antagoniste du calcium, est lui-même dans la recherche sur les animaux un incapaciteur d'efflux qui peut augmenter substantiellement la pénétration dans le cerveau de médicaments appliqués ultérieurement. Ceci a été démontré sur un modèle animal en particulier pour des vinca-alcaloïdes cytostatiques[103],[104]. Les procyanidines présentent des propriétés semblables[105].
L'inconvénient de l'utilisation des inhibiteurs d'efflux est que les inhibiteurs administrés, en particulier ceux de la première génération, comme le vérapamil et la ciclosporine, ont eux-mêmes une action pharmacologique, et présentent donc toute une série d'effets secondaires indésirables. Pour les inhibiteurs de la glycoprotéine P de deuxième et troisième génération, ces effets sont significativement réduits[91]. En outre, toutes les cellules qui expriment la glycoprotéine P sont touchées de la même manière. Par exemple, par injection intraveineuse d'inhibiteurs d'efflux, la face apicale des épithémiums d'intestin, des canalicules biliaires, des tubules rénaux, ou du placenta, ainsi que la face luminale des capillaires irriguant les tubes séminifères[106]. La protéine de résistance au cancer mammaire (ABCG2) est le deuxième transporteur d'efflux de la barrière hémato-encéphalique par ordre d'importance, mais n'a apparemment aucune influence sur le transport de médicaments[91]. Ceci a été établi par des expériences sur des souris knock-out auxquelles le gène ABCG2 avait été rendu inactif[107].
L'inhibition d'efflux est principalement explorée pour la thérapie du cancer, parce que beaucoup de cellules cancéreuses expriment fortement la glycoprotéine P au cours de la thérapie, et se soustraient ainsi largement à l'action des cytostatiques. Les tumeurs ne répondent alors plus à l'administration de cytostatiques[108],[109],[110].
Actions sur les jonctions serrées

À côté des deux classes de stratégies exposées précédemment, mécanique et concernant la chimie des interactions entre les molécules que l'on veut introduire et les cellules endothéliales, il existe pour l'ouverture de la barrière hémato-encéphalique à but thérapeutique un autre type de stratégie pour introduire dans le cerveau des médicaments qui normalement ne peuvent pas franchir la barrière. Il s'agit ici de pratiquer une ouverture aussi réversible que possible, ou tout simplement un relâchement, des jonctions serrées, pour permettre un transport paracellulaire des médicaments dans le cerveau. Avec la connaissance croissante que nous avons de la construction moléculaire de la barrière hémato-encéphalique, et en particulier des jonctions serrées, il a été possible de mettre au point de nouveaux voies et moyens pour pratiquer l'ouverture pharmaceutique et physique de ces jonctions serrées[111]. La plupart de ces procédés se trouvent encore en phase préclinique de test.
Quand on ouvre la barrière hémato-encéphalique, on court en général le risque de faire diffuser dans le cerveau des protéines plasmatiques toxiques pour lui, et ainsi déclencher des maladies neuropathologiques chroniques[112].
Modulation des jonctions serrées
Les composés qui ont une influence sur les jonctions serrées sont appelés modulateurs de jonctions serrées. Par les progrès dans les domaines de la préparation génomique de substances, du criblage à haut débit (High throughput screening), de la chimie combinatoire et de la bio-informatique, on a isolé et/ou identifié toute une série de substances, qui peuvent cibler des peptides individuels de la jonction serrée ou de la jonction adhérente et de moduler ainsi le contact entre cellules endothéliales[113],[114].
Les modulateurs qui visent directement les jonctions serrées sont par exemple dérivés des entérotoxines des bactéries Vibrio cholerae ou Clostridium perfringens . Le Vibrio cholerae, agent du choléra, produit entre autres la ZOT (Zonula occludens toxin), toxine dirigée contre la jonction étanche. C'est une protéine composée de 399 acides aminés, de masse 45 kDa, qui interagit dans l'intestin avec un récepteur de surface, le récepteur-ZOT de l'endothélium. Sa capture déclenche une cascade de signaux intracellulaires, encore mal élucidée. Mais entre autres, la protéine kinase A, qui catalyse la déconstruction des jonctions serrées[115],[116]. Sur des cultures monocouches d'endothélium cérébral, la ZOT provoque in vitro une réduction substantielle de la résistance électrique trans-endothéliale (TEER – Trans Endothelial Electrical Resistance), qui est réversible. La perméabilité paracellulaire pour des molécules marqueurs telles que le saccharose, l'inuline, le paxlitaxel et la doxorubicine est significativement augmentée[117]. Le fragment actif ΔG de la ZOT, de masse 12 kDa, et même le domaine actif de seulement 6 acides aminés (en code alphabétique FCIGRL) se lient au récepteur-ZOT[111],[118].
Le peptide composé de 44 acides aminés OCC2 se lie sélectivement au deuxième domaine de la protéine de jonction serrée occludine, ce qui facilite de même le transport paracellulaire[119].
La bradykinine, est un oligopeptide constitué de neuf acides aminés (RPPGFSPFR), et puissant vasodilatateur, qui se lie aux récepteurs B2 de la face luminale des endothéliums. Il s'ensuit un accroissement de la concentration en ions calcium libres dans la cellule, qui à son tour active le complexe actine-myosine lié aux protéines transmembranaires occludine et claudine de la jonction serrée, ce qui ouvre la jonction serrée[7],[120],[121].
Ouverture osmotique de la barrière hémato-encéphalique

Peu après la découverte des jonctions serrées, on émit la thèse que l'action de solutions sur les cellules endothéliales pourrait ouvrir la barrière hémato-encéphalique[122]. En 1980, cette méthode est appliquée pour la première fois[123], et en 1984, la preuve expérimentale de cette thèse est rapportée par des examens au microscope électronique : des marqueurs opaques aux électrons diffusent dans le cerveau par les jonctions serrées[124].
Des solutions hyperosmolaires, par exemple de mannitol ou d'arabinose, sont infusées par l'artère carotide interne. La différence de pression osmotique entre les cellules endothéliales et la solution infusée provoque une perte de liquide dans les cellules endothéliales, et par suite à leur rétrécissement. Ce dernier engendre des forces de traction entre les cellules, ce qui conduit à l'ouverture des jonctions serrées, c'est-à-dire de la barrière hémato-encéphalique[125],[126].
En raison du gradient de concentration entre la lumière du capillaire et le parenchyme, l'eau passe à grand débit du plasma vers le cerveau. Les substances dissoutes dans l'eau sont entraînées dans le cerveau, et un œdème se forme[123],[127],[128],[129],[130].
L'ouverture des jonctions serrées pratiquée par le rétrécissement des cellules endothéliales mesure environ 20 nm. Les molécules de diamètre effectif en solution jusqu’à 20 nm peuvent donc diffuser dans le cerveau[131]. L'ouverture de la barrière hémato-encépalique par cette méthode est réversible : entre 10 et 120 min environ après l'infusion, la barrière est totalement rétablie[132],[121]. On peut la prolonger par un traitement préalable avec des bloqueurs de canaux Na+/Ca2+. Le temps d'action de la solution hyperosmolaire est d'environ 30 s.
Le procédé a été testé sur des animaux avec toute une série de substances solubles, des peptides, des anticorps, des enzymes et des vecteurs viraux pour thérapie génique. Un ensemble d'études cliniques sur la chimiothérapie des tumeurs du cerveau ont été poursuivies dans diverses cliniques[133]. Les résultats en sont très prometteurs[134].
Ultrasons





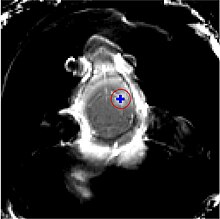
La barrière hémato-encéphalique peut être ouverte par des ultrasons focalisés. Cet effet a été démontré pour la première fois en 1956. L'ouverture de la barrière hémato-encéphalique a pu être démontrée par la coloration au bleu de trypan, un colorant qui normalement ne franchit pas la barrière hémato-encéphalique, et par la pénétration de phosphate marqué radioactivement. Au microscope, on ne pouvait pas observer de modification de l’endothélium. Mais l'utilisation des ultrasons a conduit à des dommages cérébraux[135]. En 1960, la barrière hémato-encéphalique a été franchie pour la première fois avec des ultrasons avec des dommages minimes pour le parenchyme avoisinant[136]. Toutes ces expériences étaient menées avec des ultrasons focalisés de haute puissance, dans la région de 4 000 W/cm2. Ceci provoquait des bulles de cavitation, qui pouvaient détruire les tissus de façon irréversible[6].
- Ultrasons focalisés avec des microbulles
L'ouverture de la barrière hémato-encéphalique par ultrasons et une administration simultanée de microbulles (microbubbles) a été pratiquée pour la première fois en 2001[137]. L'idée en est que pour éviter d'engendrer des bulles de cavitation, il faut injecter des microbulles pour prendre la fonction qui serait autrement remplie par les bulles créées par la cavitation. Ainsi, on peut diminuer significativement la puissance des ultrasons ; il n'y a plus de danger de surchauffe alors ni pour le crâne, ni pour le tissu environnant. La technique est maintenant assez développée pour que l’on ne constate plus ni apoptose ni ischémie ou dommage à long terme dans le cerveau. Quelques heures après le traitement, la barrière hémato-encéphalique a repris son état normal[6].
Les ultrasons peuvent être focalisés sur n'importe quel domaine du cerveau. C'est ainsi que l'on peut ouvrir la barrière hémato-encéphalique sélectivement sur des régions délimitées du cerveau. Les médicaments administrés pénétreront alors sur la zone ainsi ciblée[138]. On peut suivre le ciblage des zones par une IRM simultanée : il suffit d'administrer un produit de contraste IRM, comme du gadolinium convenablement chélaté, qui pénètre dans le cerveau à travers les parties de la barrière hémato-encéphalique ouvertes. Ces parties deviennent alors visibles en IRM. Les produits de contraste ne sont pas en mesure de franchir la barrière aux endroits où elle n'est pas ouverte.
Sur le modèle animal de la souris, on a utilisé des ultrasons focalisés dans le domaine de 0,5 à 2 MHz[139], avec de brèves impulsions de l'ordre de la milliseconde, répétées à intervalles de 1 s, pour une durée totale inférieure à une minute[140]. La fréquence optimale se situe au-dessous de 1 MHz[141]. La puissance acoustique instantanée est inférieure au watt, et donc la puissance moyenne de l'ordre du mW. Les microbulles utilisées sont en général des microbulles autorisées pour l'échocardiographie de contraste. Elles ont typiquement un diamètre de 3 à 5,5 μm, et sont composées typiquement d'albumine humaine, remplie d'octafluoropropane ou de gaz lourd semblable[142].
- Mécanisme
Le mécanisme de l'ouverture de la barrière hémato-encéphalique par utilisation d'ultrasons focalisés et de microbulles n'est pas encore complètement élucidé. L'interaction entre les ultrasons et les microbulles y joue un grand rôle, et conduit in vivo à toute une série d'effets biologiques[143]. Il semble qu'un grand rôle est joué par les forces de cisaillement créées par les microcourants. Ces microcourants eux-mêmes proviennent des oscillations des microbulles dans le champ d'ultrasons[143]. On sait déjà que les endothéliums peuvent réagir dynamiquement aux forces de cisaillement, et que ces forces de cisaillement sont une grandeur critique pour l'homéostasie[144]. Les vues en microscopie électronique des capillaires d'animaux ainsi traités présentent des signes aussi bien de transport transcellulaire que paracellulaire de molécules marqueurs (péroxydase du raifort). Le transport transcellulaire est la transcytose, tandis que le transport paracellulaire est initié par un processus complexe de désintégration, qui fait perdre leur fonction aux jonctions serrées[145].
La barrière hémato-encéphalique ainsi ouverte est perméable pour les médicaments de chimiothérapie de faible masse moléculaire, comme la doxorubicine[146], et des anticorps come le Trastuzumab[147],[148],[149]. La faisabilité de principe du transport dans le cerveau a été démontrée avec cette méthode même pour des gènes sur des modèles animaux[150],[142]. Le procédé d'ouverture de la barrière hémato-encéphalique par ultrasons et injection simultanée de microbulles en est encore à ses débuts. Jusqu'à présent, il n'a été testé que sur des animaux. L'expérience conduit à penser qu'il se passera encore de nombreuses années jusqu’à ce qu'il soit autorisé sur l’homme.
L'échographie à but d'imagerie diagnostique, sans focalisation des ultrasons n'a pas d'influence sur l'intégrité de la barrière hémato-encéphalique[151].
Notes et références
- (en) A. Tsuji, « Small Molecular Drug Transfer across the Blood-Brain Barrier via Carrier-Mediated Transport Systems. », NeuroRx, vol. 2, , p. 54–62 (PMID 15717057, lire en ligne, consulté le ) (Article de revue)
- (en) W. M. Pardridge, « Blood-brain barrier drug targeting : the future of brain drug development. », Mol Interv, vol. 3, , p. 90–105 (PMID 14993430, lire en ligne, consulté le ) (Article de revue)
- (en) Ajay et coll., « Designing libraries with CNS activity. », J Med Chem, vol. 42, , p. 4942–4951 (PMID 10585204)
- (en) A. K. Ghose et coll., « A knowledgebased approach in designing combinatorial or medicinal chemistry libraries for drug discovery. 1. A qualitative and quantitative characterization of known drug databases. », J Comb Chem, vol. 1, , p. 55–68 (PMID 10746014)
- (en) W. M. Pardridge, « The blood-brain barrier : bottleneck in brain drug development. », NeuroRx, vol. 2, , p. 3–14 (PMID 15717053, lire en ligne, consulté le ) (Article de revue)
- (en) N. Vykhodtseva et coll., « Progress and problems in the application of focused ultrasound for blood-brain barrier disruption. », Ultrasonics, vol. 48, , p. 279–296 (PMID 18511095)
- (en) D. J. Begley, « Delivery of therapeutic agents to the central nervous system : the problems and the possibilities. », Pharmacol Ther, vol. 104, , p. 29–45 (PMID 15500907) (Article de revue)
- (en) W. M. Pardridge, « Why is the global CNS pharmaceutical market so under-penetrated? », Drug Discovery Today, vol. 7, , p. 5–7 (PMID 11790589)
- (en) A. G. de Boer et P. J. Gaillard, « Strategies to improve drug delivery across the blood-brain barrier. », Clin Pharmacokinet, vol. 46, , p. 553–576 (PMID 17596102) (Article de revue)
- (en) A. G. de Boer et P. J. Gaillard, « Drug targeting to the brain. », Annu Rev Pharmacol Toxicol, :en:Annual Reviews (publisher), vol. 47, , p. 323–355 (PMID 16961459) (Article de revue)
- (en) G. Fleischhack et coll., « Pharmacokinetics following intraventricular administration of chemotherapy in patients with neoplastic meningitis. », Clin Pharmacokinet., vol. 44, , p. 1–31 (PMID 15634030)
- (en) J. Z. Kerr et coll., « Intrathecal chemotherapy. », Crit Rev Oncol Hematol, vol. 37, , p. 227–236 (PMID 11248578)
- (en) S. Stapleton et S. Blaney, « New agents for intrathecal administration. », Cancer Invest, vol. 24, , p. 528–534 (PMID 16939963)
- (en) Y. L. Kwong et coll., « Intrathecal chemotherapy for hematologic malignancies : drugs and toxicities. », Ann Hematol, vol. 88, , p. 193–201 (PMID 19050889)
- (en) S. L. Berg et M. C. Chamberlain, « Current treatment of leptomeningeal metastases : systemic chemotherapy, intrathecal chemotherapy and symptom management. », Cancer Treat Res, vol. 125, , p. 121–146 (PMID 16211887)
- (en) A. Ruggiero et coll., « Intrathecal chemotherapy with antineoplastic agents in children. », Paediatr Drugs, vol. 3, , p. 237–246 (PMID 11354696)
- (de) H. Schneider, « Implantierbare Medikamentenpumpen », dans Implantatekatalog, vol. 3, Medizinischer Dienst der Spitzenverbände der Krankenkassen e. V.,
- (en) E. S. Krames, « Intrathecal Infusional Therapies for Intractable Pain: Patient Management Guidelines. », J Pain Symptom Manage, , p. 36–46 (PMID 8482892)
- (en) V. L. Ghafoor et coll., « Intrathecal drug therapy for long-term pain management. », Am J Health Syst Pharm, vol. 64, , p. 2447–2461 (PMID 18029950)
- (en) G. Ochs et coll., « Intrathecal baclofen for long-term treatment of spasticity : a multi-centre study. », J Neurol Neurosurg Psychiatry., vol. 52, , p. 933–939 (PMID 2487035)
- (de) Günter Ochs, « Therapeutische Möglichkeiten von Wachstumsfaktoren bei neuromuskulären Erkrankungen. », (consulté le )
- (en) P. M. Brennan et I. R. Whittle, « Intrathecal baclofen therapy for neurological disorders : a sound knowledge base but many challenges remain. », Br J Neurosurg, vol. 22, , p. 508–519 (PMID 18649160)
- (en) R. D. Penn et J. S. Kroin, « Intrathecal Baclofen alleviates spinal cord spacicity. », The Lancet, vol. 8385, , p. 1078 (PMID 6144008)
- (en) K. S. Lewis et W. M. Mueller, « Intrathecal baclofen for severe spasticity secondary to spinal cord injury. », Ann Pharmacother, vol. 27, , p. 767–774 (PMID 8329801)
- (en) A. Dario et G. Tomei, « A benefit-risk assessment of baclofen in severe spinal spasticity. », Drug Saf, vol. 27, , p. 799–818 (PMID 15350152) (Article de revue)
- (en) Y. W. Cheung et coll., « Stability of cytarabine, methotrexate sodium, and hydrocortisone sodium succinate admixtures. », Am J Hosp Pharm, vol. 41, , p. 1802–1806 (PMID 6496516) (Article de revue)
- (en) Q. Yan et coll., « Distribution of intracerebral ventricularly administered neurotrophins in rat brain and its correlation with trk receptor expression. », Exp Neurol, vol. 127, , p. 23–36 (PMID 8200435)
- (en) W. M. Pardridge, « CNS drug design based on principles of blood-brain barrier transport. », J Neurochem, vol. 70, , p. 1781–1792 (PMID 9572261) (Article de revue)
- (en) E. M. Kemper et coll., « Modulation of the blood-brain barrier in oncology : therapeutic opportunities for the treatment of brain tumours? », Cancer Treat Rev, vol. 30, , p. 415–423 (PMID 15245774) (Article de revue)
- (en) L. R. Hanson et W. H. Frey, « Intranasal delivery bypasses the blood-brain barrier to target therapeutic agents to the central nervous system and treat neurodegenerative disease. », BMC Neurosci., vol. 9 Suppl 3, , S5 (PMID 19091002, DOI 10.1186/1471-2202-9-S3-S5, lire en ligne, consulté le )
- (en) L. Danielyan, R. Schäfer, A. von Ameln-Mayerhofer et coll., « Intranasal delivery of cells to the brain. », Eur. J. Cell Biol., vol. 88, , p. 315–324 (PMID 19324456, DOI 10.1016/j.ejcb.2009.02.001)
- (en) G. Miller, « Drug targeting. Breaking down barriers. », Science, vol. 297, , p. 1116–1118 (PMID 12183610)
- (en) M. D. Habgood et coll., « Determinants of passive drug entry into the central nervous system. », Cell Mol Neurobiol, vol. 20, , p. 231–253 (PMID 10696512)
- (en) W. H. Oldendorf, « Lipid solubility and drug penetration of the blood-brain barrier. », Proc Soc Exp Biol Med, vol. 147, , p. 813–816 (PMID 4445171)
- (en) W. H. Oldendorf et coll., « Blood-brain barrier : penetration of morphine, codeine, heroin, and methadone after carotid injection. », Science, , p. 984–986 (PMID 5084666)
- (en) D. Patel et coll., « Peptide targeting and delivery across the blood-brain barrier utilizing synthetic triglyceride esters : design, synthesis, and bioactivity. », Bioconjug Chem, vol. 8, , p. 434–441 (PMID 9177851)
- (de) E. Mutschler et coll., Mutschler Arzneimittelwirkungen., Stuttgart, Wissenschaftliche Verlagsgesellschaft, , 9e éd., 1244 p., relié (ISBN 978-3-8047-1952-1)
- (en) D. M. Killian et coll., « Modulating blood-brain barrier interactions of amino acid-based anticancer agents. », Drug Deliv, vol. 7, , p. 21–25 (PMID 10895416)
- (en) Y. Takada et coll., « Affinity of antineoplastic amino-acid drugs for the large neutral amino acid transporter of the blood–brain barrier. », Cancer Chemother Pharmacol, vol. 30, , p. 89–94 (PMID 1760863)
- (en) Paris-Robidas S, Brouard D, Emond V, Parent M et Calon F, « Internalization of targeted quantum dots by brain capillary endothelial cells in vivo. Journal of cerebral blood flow and metabolism », Official journal of the International Society of Cerebral Blood Flow and Metabolism, , p. 731-42 (ISSN 1559-7016, lire en ligne)
- (de) A. Bootz, Entwicklung, Charakterisierung und Testung von Nanopartikeln zur Überwindung der Blut-Hirn-Schranke auf Basis von Poly(butylcyanoacrylat). : Thèse d'État, Francfort-sur-le-Main, (lire en ligne)
- (en) J. Temsamani et coll., « Vector-mediated drug delivery to the brain. », Expert Opin Biol Ther, vol. 1, , p. 773–782 (PMID 11728213, résumé) (Article de revue)
- (en) R. L. Roberts et coll., « Receptor-mediated endocytosis of transferrin at the blood-brain barrier. », J Cell Sci, vol. 104, , p. 521–532 (PMID 8505377, lire en ligne, consulté le )
- (en) B. Dehouck et coll., « Upregulation of the low density lipoprotein receptor at the blood-brain barrier : intercommunications between brain capillary endothelial cells and astrocytes. », J Cell Biol, vol. 126, , p. 465–473 (PMID 8034745, lire en ligne)
- (en) K. R. Duffy et coll., « Human blood-brain barrier insulin-like growth factor receptor. », Metabolism, vol. 37, , p. 136–140 (PMID 2963191)
- (en) U. Bickel et coll., « Pharmacologic effects in vivo in brain by vector-mediated peptide drug delivery. », PNAS, vol. 90, , p. 2618–2622 (PMID 8385339, lire en ligne)
- (en) T. Moos et E. H. Morgan, « Restricted transport of anti-transferrin receptor antibody (OX26) through the blood–brain barrier in the rat. », Journal of Neurochemistry, vol. 79, , p. 119–129 (PMID 11595764)
- (en) W. M. Pardridge et coll., « Human insulin receptor monoclonal antibody undergoes high affinity binding to human brain capillaries in vitro and rapid transcytosis through the blood– brain barrier in vivo in the primate. », Pharm Res, vol. 12, , p. 807–816 (PMID 7667183)
- (en) W. M. Pardridge, « Non-invasive drug delivery to the human brain using endogenous blood–brain barrier transport system. », Pharmacol Sci Technol Today, vol. 2, , p. 49–59 (PMID 10234207)
- (en) W. M. Pardridge et coll., « Transport of human recombinant brain-derived neurotrophic factor (BDNF) through the rat blood–brain barrier in vivo using vector-mediated peptide drug delivery. », Pharm Res, vol. 11, , p. 738–746 (PMID 8058646)
- (en) J. M. Scherrmann, « Drug delivery to brain via the blood-brain barrier. », Vascul Pharmacol, vol. 38, , p. 349–354 (PMID 12529929) (Article de revue)
- (en) D. Karkan et coll., « A unique carrier for delivery of therapeutic compounds beyond the blood-brain barrier. », PLoS ONE, vol. 3, , e2469 (PMID 18575595, lire en ligne)
- (en) C. Rousselle et coll., « New advances in the transport of doxorubicin through the blood-brain barrier by a peptide vector-mediated strategy. », Mol Pharmacol, vol. 57, , p. 679–686 (PMID 10727512, lire en ligne)
- (en) C. Rousselle et coll., « Enhanced delivery of doxorubicin into the brain via a peptide vector-mediated strategy : saturation kinetics and specificity. », J Pharmacol Exp Ther, vol. 296, , p. 124–131 (PMID 11123372, lire en ligne)
- (en) B. Christiaens et coll., « Tryptophan fluorescence study of the interaction of penetratin peptides with model membranes. », FEBS Journal, vol. 269, , p. 2918–2926 (PMID 12071955)
- (en) S. R. Schwarze et coll., « In vivo protein transduction : delivery of a biologically active protein into the mouse. », Science, vol. 285, , p. 1569–1572 (PMID 10477521)
- (en) M. Pooga et coll., « Cell penetration by transportan. », FASEB, vol. 12, , p. 67–77 (PMID 9438412, lire en ligne)
- (en) F. Hervé et coll., « CNS delivery via adsorptive transcytosis. », AAPS J, vol. 10, , p. 455–472 (PMID 18726697) (Article de revue)
- (en) M. W. Smith et M. Gumbleton, « Endocytosis at the blood-brain barrier : from basic understanding to drug delivery strategies. », J Drug Target, vol. 14, , p. 191–214 (PMID 16777679) (Article de revue)
- (en) I. Tamai et coll., « Structure-internalization relationship for adsorptive-mediated endocytosis of basic peptides at the blood– brain barrier. », J Pharmacol Exp Ther, vol. 280, , p. 410–415 (PMID 8996222, lire en ligne)
- (en) T. Terasaki et coll., « In vivo transport of a dynorphin-like analgesic peptide, E 2078, through the blood-brain barrier : an application of microdialysis. », J Pharmacol Exp Ther, vol. 251, , p. 815-820 (PMID 1681528)
- (de) S. Nobmann, Isolierte Gehirn-Kapillaren als in vitro-Modell der Blut-Hirn Schranke. : Thèse d'État, Heidelberg, Ruprecht-Karls-Universität, (lire en ligne)
- (en) H. H. Szeto, « Development of mitochondria-targeted aromatic-cationic peptides for neurodegenerative diseases. », Ann N Y Acad Sci, vol. 1147, , p. 112–121 (PMID 19076436)
- (en) J. F. Poduslo et coll., « Putrescine-modified nerve growth factor : bioactivity, plasma pharmacokinetics, blood– brain/nerve barrier permeability, and nervous system biodistribution. », J Neurochem, vol. 71, , p. 1651–1660 (PMID 9751199)
- (en) T. M. Wengenack et coll., « Putrescine-modified catalase with preserved enzymatic activity exhibits increased permeability at the blood-nerve and blood-brain barriers. », Brain Res, vol. 767, , p. 128–135 (PMID 9365024)
- (en) S. V. Vinogradov, T. K. Bronich et A. V. Kabanov, « Nanosized cationic hydrogels for drug delivery : preparation, properties and interactions with cells. », Adv. Drug Deliv. Rev., vol. 54, , p. 135–147 (PMID 11755709, résumé)
- (en) J. Kreuter, « Influence of the surface properties on nanoparticle-mediated transport of drugs to the brain. », J Nanosci Nanotechnol, vol. 4, , p. 484–488 (PMID 15503433) (Article de revue)
- (en) P. Blasi et coll., « Solid lipid nanoparticles for targeted brain drug delivery. », Adv Drug Deliv Rev, vol. 59, , p. 454–477 (PMID 17570559) (Article de revue)
- (en) J. C. Oliver, « Drug transport to brain with targeted nanoparticles. », NeuroRx, vol. 2, , p. 108–119 (PMID 15717062, lire en ligne) (article de revue)
- (en) P. Calvo et coll., « Long-circulating PEGylated polycyanoacrylate nanoparticles as new drug carrier for brain delivery. », Pharm Res, vol. 18, , p. 1157–1166 (PMID 11587488)
- (en) J. Kreuter, « Nanoparticulate systems for brain delivery of drugs. », Adv Drug Deliv Rev, vol. 47, , p. 65–81 (PMID 11251246) (article de revue)
- (en) J. Kreuter et S. Gelperina, « Use of nanoparticles for cerebral cancer. », Tumori, vol. 94, , p. 271–277 (PMID 18564616)
- (en) A. E. Gulyaev et coll., « Significant transport of doxorubicin into the brain with polysorbate 80-coated nanoparticles. », Pharm Res, vol. 16, , p. 1564–1569 (PMID 10554098)
- (en) A. J. Sawyer et coll., « New methods for direct delivery of chemotherapy for treating brain tumors. », Yale J Biol Med, vol. 79, , p. 141–152 (PMID 17940624, lire en ligne) (article de revue)
- (en) E. Garcia-Garcia et coll., « Colloidal carriers and blood-brain barrier (BBB) translocation : a way to deliver drugs to the brain? », Int J Pharm, vol. 298, , p. 274–292 (PMID 15896933) (article de revue)
- (en) S. B. Tiwari et M. M. Amiji, « A review of nanocarrier-based CNS delivery systems. », Curr Drug Deliv, vol. 3, , p. 219–232 (PMID 16611008) (Article de revue)
- (en) I.P. Kaur et coll., « Potential of solid lipid nanoparticles in brain targeting. », J Control Release, vol. 127, , p. 97–109 (PMID 18313785) (Article de revue)
- (en) J. L. Gilmore et coll., « Novel nanomaterials for clinical neuroscience. », J Neuroimmune Pharmacol, vol. 3, , p. 83–94 (PMID 18210200, lire en ligne) (Article de revue)
- (en) W. H. De Jong et P. J. Borm, « Drug delivery and nanoparticles :applications and hazards. », Int J Nanomedicine, vol. 3, , p. 133–149 (PMID 18686775, lire en ligne) (article de revue)
- (en) R. D. Broadwell et coll., « Morphologic effect of dimethyl sulfoxide on the blood-brain barrier. », Science, vol. 217, , p. 164–166 (PMID 7089551)
- (en) J. P. Hanig et coll., « Ethanol enhancement of blood-brain barrier permeability to catecholamines in chicks. », Eur J Pharmacol, vol. 18, , p. 79–82 (PMID 5031276)
- (en) B. Erdlenbruch et coll., « Transient and controllable opening of the blood–brain barrier to cytostatic and antibiotic agents by alkylglycerols in rats. », Exp. Brain Res, vol. 135, , p. 417–422 (PMID 11146820)
- (en) B. Erdlenbruch et coll., « Alkylglycerol opening of the blood-brain barrier to small and large fluorescence markers in normal and C6 glioma-bearing rats and isolated rat brain capillaries. », British journal of pharmacology, vol. 140, , p. 1201-1210 (PMID 14597599, lire en ligne)
- (en) H. J. Lee et coll., « Blood-brain barrier disruption following the internal carotid arterial perfusion of alkyl glycerols. », Journal of drug targeting, vol. 10, , p. 463–467 (PMID 12575736)
- (en) B. Erdlenbruch et coll., « Intracarotid administration of short-chain alkylglycerols for increased delivery of methotrexate to the rat brain. », British journal of pharmacology, vol. 139, , p. 685–694 (PMID 12812991, lire en ligne)
- (en) B. Erdlenbruch et coll., « Blood-brain barrier opening with alkylglycerols : Biodistribution of 1-O-pentylglycerol after intravenous and intracarotid administration in rats. », J Drug Target, vol. 13, , p. 143–150 (PMID 16036302)
- (en) A. Saija et coll., « Changes in the permeability of the blood-brain barrier following sodium dodecyl sulphate administration in the rat. », Exp Brain Res, vol. 115, , p. 546–551 (PMID 9262210)
- (en) M. D. Ellison et coll., « Blood-brain barrier dysfunction in cats following recombinant interleukin-2 infusion. », Cancer Res, vol. 47, , p. 5765–5770 (PMID 3499219, lire en ligne)
- (en) M. N. Azmin et coll., « The distribution and elimination of methotrexate in mouse blood and brain after concurrent administration of polysorbate 80. », Cancer Chemother Pharmacol, vol. 14, , p. 238–242 (PMID 3995684)
- (en) T. Sakane et coll., « The effect of polysorbate 80 on brain uptake and analgesic effect of D-kyotorphin. », Int J Pharm, vol. 57, , p. 238–242
- (en) Y. Su et P. J. Sinko, « Drug delivery across the blood-brain barrier : why is it difficult? how to measure and improve it? », Expert Opin Drug Deliv, vol. 3, , p. 419–435 (PMID 16640501) (Article de revue)
- (en) A. H. Schinkel et coll., « Disruption of the mouse mdr1a P-glycoprotein gene leads to a deficiency in the blood-brain barrier and to increased sensitivity to drugs. », Cell, vol. 77, , p. 491–502 (PMID 7910522)
- (en) P. Jolliet-Riant et J. P. Tillement, « Drug transfer across the blood-brain barrier and improvement of brain delivery. », Fundam Clin Pharmacol, vol. 13, , p. 16–26 (PMID 10027084) (Article de revue)
- (en) W. Löscher et H. Potschka, « Blood-brain barrier active efflux transporters: ATP-binding cassette gene family. », NeuroRx, vol. 2, no 1, , p. 86-98 (PMID 15717060, lire en ligne)
- (en) R. B. Kim et coll., « The drug transporter P-glycoprotein limits oral absorption and brain entry of HIV-1 protease inhibitors. », J Clin Investig, vol. 101, , p. 289–294 (PMID 9435299, lire en ligne)
- (en) E. M. Kemper et coll., « Increased penetration of paclitaxel into the brain by inhibition of P-glycoprotein. », Clin. Cancer Res., vol. 9, , p. 2849–2855 (PMID 12855665, lire en ligne)
- (en) E. M. Kemper et coll., « The influence of the P-glycoprotein inhibitor zosuquidar trihydrochloride (LY335979) on the brain penetration of paclitaxel in mice. », Cancer Chemother Pharmacol, vol. 53, , p. 173–178 (PMID 14605863)
- (en) E. M. Kemper et coll., « Improved penetration of docetaxel into the brain by co-administration of inhibitors of P-glycoprotein. », Eur J Cancer, vol. 40, , p. 1269–1274 (PMID 15110893)
- (en) U. Mayer et coll., « Full blockade of intestinal P-glycoprotein and extensive inhibition of blood-brain barrier P-glycoprotein by oral treatment of mice with PSC833. », J Clin Investig, vol. 100, , p. 2430–2436 (PMID 9366556, lire en ligne)
- (en) N. H. Hendrikse et coll., « Complete in vivo reversal of P-glycoprotein pump function in the blood-brain barrier visualized with positron emission tomography. », Br J Pharmacol, vol. 124, , p. 1413–1418 (PMID 9723952, lire en ligne)
- (en) H. Kusuhara et coll., « P-Glycoprotein mediates the efflux of quinidine across the blood-brain barrier. », J Pharmacol Exp Ther, vol. 283, , p. 574–580 (PMID 9353372, lire en ligne)
- (en) P. Hsiao et coll., « Verapamil P-glycoprotein transport across the rat blood-brain barrier : cyclosporine, a concentration inhibition analysis, and comparison with human data. », J Pharmacol Exp Ther., vol. 317, , p. 704–710 (PMID 16415090, lire en ligne)
- (en) N. Drion et coll., « Role of P-glycoprotein in the blood-brain transport of colchicine and vinblastine. », J Neurochem, vol. 67, , p. 1688–1693 (PMID 8858954)
- (de) I. Sauer, Apolipoprotein E abgeleitete Peptide als Vektoren zur Überwindung der Blut-Hirn-Schranke. : Thèse d'État, Berlin, Freie-Universität, (lire en ligne)
- (en) L. He et coll., « Inhibition of P-glycoprotein function by procyanidine on blood-brain barrier. », Phytother Res, vol. 23, , p. 933–937 (PMID 19172664)
- (en) S. F. Zhou, « Structure, function and regulation of P-glycoprotein and its clinical relevance in drug disposition. », Xenobiotica, vol. 38, , p. 802–832 (PMID 18668431) (Article de revue)
- (en) Y. J. Lee et coll., « Investigation of efflux transport of dehydroepiandrosterone sulfate and mitoxantrone at the mouse blood-brain barrier : a minor role of breast cancer resistance protein. », J Pharmacol Exp Ther, vol. 312, , p. 44–52 (PMID 15448171, lire en ligne)
- (en) H. Yuan et coll., « Strategies to overcome or circumvent P-glycoprotein mediated multidrug resistance. », Curr Med Chem, vol. 15, , p. 470–476 (PMID 18289002) (Article de revue)
- (en) H. M. Coley, « Mechanisms and strategies to overcome chemotherapy resistance in metastatic breast cancer. », Cancer Treat Rev, vol. 34, , p. 378–390 (PMID 18367336) (Article de revue)
- (en) S. Nobili et coll., « Pharmacological strategies for overcoming multidrug resistance. », Curr Drug Targets, vol. 7, , p. 861–879 (PMID 16842217) (Article de revue)
- (en) N. N. Salama et coll., « Tight junction modulation and its relationship to drug delivery. », Adv Drug Deliv, vol. 58, , p. 15–28 (PMID 16517003)
- (en) N. S. Ningaraj, « Drug delivery to brain tumours : challenges and progress. », Expert Opin Drug Deliv, vol. 3, , p. 499–509 (PMID 16822225)
- (en) M. Kondoh et K. Yagi, « Tight junction modulators : promising candidates for drug delivery. », Curr Med Chem, vol. 14, , p. 2482–2488 (PMID 17979701) (Article de revue)
- (en) P. H. Johnson et coll., « Discovery of tight junction modulators : significance for drug development and delivery. », Drug Discov Today, vol. 13, , p. 261–267 (PMID 18342803) (Article de revue)
- (en) A. Fasano et coll., « Zonula occludens toxin modulates tight junctions through protein kinase C-dependent actin reorganization, in vitro. », J Clin Invest, vol. 96, , p. 710–720 (PMID 7635964, lire en ligne)
- (en) M. A. Deli, « Potential use of tight junction modulators to reversibly open membranous barriers and improve drug delivery. », Biochim. Biophys. Acta, vol. 1788, , p. 892–910 (PMID 18983815) (Article de revue)
- (en) C. S. Karyekar et coll., « Zonula occludens toxin increases the permeability of molecular weight markers and chemotherapeutic agents across the bovine brain microvessel endothelial cells. », J Pharm Sci, vol. 92, , p. 414–423 (PMID 12532391)
- (en) K.-H. Song et coll., « Effect of the six-mer synthetic peptide (AT1002) fragment of zonula occludens toxin on the intestinal absorption of cyclosporin A. », Int J Pharm, vol. 351, , p. 8–14 (PMID 17954018)
- (en) V. Wong et B. Gumbiner, « A synthetic peptide corresponding to the extracellular domain of occludin perturbs the tight junction permeability barrier. », J Cell Biol, vol. 136, , p. 399–409 (PMID 9015310, lire en ligne)
- (de) S. Zausinger, « Bradykinin receptor antagonists in cerebral ischemia and trauma. », IDrugs, vol. 6, , p. 970–975 (PMID 14534854) (Article de revue)
- (de) N. Hettenbach, Einfluss chronischer elektromagnetischer Befeldung mit Mobilfunkstrahlen (GSM und UMTS) auf die Integrität der Blut-Hirn-Schranke von Ratten. : Thèse d'État, Munich, Ludwig-Maximilians-Universität,
- (en) S. I. Rapoport et coll., « Testing of a hypothesis for osmotic opening of the blood-brain barrier. », Am J Physiol, vol. 223, , p. 323–331 (PMID 5046750)
- (en) S. I. Rapoport et coll., « Quantitative aspects of reversible osmotic opening of the blood-brain barrier. », Am. J. Physiol., vol. 238, , p. 421–431 (PMID 7377381)
- (en) K. Dorovini-Zis, « Hyperosmotic arabinose solutions open the tight junctions between brain capillary endothelial cells in tissue culture. », Brain Res, vol. 302, , p. 383–386 (PMID 6733518)
- (en) S. I. Rapoport, « Effect of concentrated solutions on the blood-brain barrier. », Am J Physiol, vol. 219, , p. 270–274 (PMID 5424853)
- (en) S. I. Rapoport et coll., « Reversible osmotic opening of the blood-brain barrier. », Science, vol. 173, , p. 1026–1028 (PMID 5098961)
- (en) Neuwelt E. A. et coll., « Use of enhanced computerized tomography to evaluate osmotic blood-brain barrier disruption. », Neurosurgery, vol. 6, , p. 49–56 (PMID 6153461)
- (en) Y. Z. Zilyan et coll., « Blood-brain barrier permeability to sucrose and dextran after osmotic opening. », Am J Physiol, vol. 247, , R634–R638 (PMID 6208789)
- (en) P. J. Robinson et S. I. Rapoport, « Model for drug uptake by brain tumors : Effects of osmotic treatment and of diffusion in brain. », J Cereb Blood flow Metab, vol. 10, , p. 153–161 (PMID 2303532)
- (en) P. J. Robinson et S. I. Rapoport, « Size selectivity of blood-brain barrier permeability at various times after osmotic opening. », Am J Physiol, vol. 253, , R459–R466 (PMID 2443025)
- (en) S. I. Rapoport, « Osmotic opening of the blood-brain barrier : principles, mechanism, and therapeutic applications. », Cell Mol Neurobiol, vol. 3, , p. 217-230 (PMID 10696511)
- (en) S. I. Rapoport, « Modulation of the blood-brain barrier permeability. », Journal of Drug Targeting, vol. 3, , p. 417-425 (PMID 8863135)
- (en) S. I. Rapoport, « Advances in osmotic opening of the blood-brain barrier to enhance CNS chemotherapy. », Expert Opin Investig Drugs, vol. 10, , p. 1809–1818 (PMID 11772287) (Article de revue)
- (en) K. Jahnke et coll., « Intraarterial chemotherapy and osmotic blood-brain barrier disruption for patients with embryonal and germ cell tumors of the central nervous system. », Cancer, vol. 112, , p. 581–588 (PMID 18072268)
- (en) L. Bakay et coll., « Ultrasonically produced changes in the blood–brain barrier. », Arch Neurol Psychat, vol. 76, , p. 457–467 (PMID 13371961)
- (en) H. T. Ballantine et coll., « Progress and problems in the neurological applications of focused ultrasound. », J Neurosurg, vol. 17, , p. 858–876 (PMID 13686380)
- (en) K. Hynynen et coll., « Noninvasive MR imaging-guided focal opening of the blood–brain barrier in rabbits. », Radiology, vol. 220, , p. 640–646 (PMID 11526261, lire en ligne)
- (en) S. Meairs et A. Alonso, « Ultrasound, microbubbles and the blood-brain barrier. », Prog Biophys Mol Biol, vol. 93, , p. 354–362 (PMID 16959303) (Article de revue)
- (en) H. L. Liu et coll., « Magnetic resonance imaging enhanced by superparamagnetic iron oxide particles : usefulness for distinguishing between focused ultrasound-induced blood-brain barrier disruption and brain hemorrhage. », J Magn Reson Imaging, vol. 29, , p. 31–38 (PMID 19097103)
- (en) N. McDannold et coll., « Effects of acoustic parameters and ultrasound contrast agent dose on focused-ultrasound induced blood-brain barrier disruption. », Ultrasound Med Biol, vol. 34, , p. 930–937 (PMID 18294757, lire en ligne, consulté le )
- (en) G. T. Clement et K. Hynynen, « A non-invasive method for focusing ultrasound through the human skull. », Phys Med Biol, vol. 47, , p. 1219–1236 (PMID 12030552)
- (en) K. Hynynen, « Ultrasound for drug and gene delivery to the brain. », Advanced Drug Delivery Reviews, vol. 60, , p. 1209–1217 (PMID 18486271) (Article de revue)
- (en) W. L. Nyborg, « Biological effects of ultrasound : development of safety guidelines. Part II : general review. », Ultrasound Med Biol, vol. 27, , p. 301–333 (PMID 11369117)
- (en) L. Krizanac-Bengez et coll., « The cerebral vasculature as a therapeutic target for neurological disorders and the role of shear stress in vascular homeostatis and pathophysiology. », Neurol Res, vol. 26, , p. 846–853 (PMID 15727268) (Article de revue)
- (en) N. Sheikov et coll., « Effect of focused ultrasound applied with an ultrasound contrast agent on the tight junctional integrity of the brain microvascular endothelium. », Ultrasound Med Biol, vol. 34, , p. 1093–1104 (PMID 18378064)
- (en) L. H. Treat et coll., « Targeted delivery of doxorubicin to the rat brain at therapeutic levels using MRI-guided focused ultrasound. », Int J Cancer, vol. 121, , p. 901–907 (PMID 17437269)
- (en) M. Kinoshita et coll., « Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. », PNAS, vol. 103, , p. 11719–11723 (PMID 16868082, lire en ligne)
- (en) M. Kinoshita et coll., « Targeted delivery of antibodies through the blood-brain barrier by MRI-guided focused ultrasound. », Biochem Biophys Res Commun, vol. 340, , p. 1085–1090 (PMID 16403441)
- (en) S. B. Raymond et coll., « Ultrasound Enhanced Delivery of Molecular Imaging and Therapeutic Agents in Alzheimer's Disease Mouse Models. », PLoS ONE, vol. 3, , e2175 (PMID 18478109, lire en ligne)
- (en) N. Sheikov et coll., « Brain arterioles show more active vesicular transport of blood-borne tracer molecules than capillaries and venules after focused ultrasound-evoked opening of the blood-brain barrier. », Ultrasound Med Biol, vol. 32, , p. 1399–1409 (PMID 16965980)
- (en) G. J. Jungehulsing et coll., « Diagnostic transcranial ultrasound perfusion-imaging at 2.5 MHz does not affect the blood-brain barrier. », Ultrasound Med Biol, vol. 34, , p. 147–150 (PMID 17854981)
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Konzepte zur Überwindung der Blut-Hirn-Schranke » (voir la liste des auteurs).
Annexes
Bibliographie
- (en) A. G. De Boer et W. Sutanto, Drug Transport Across the Blood-brain Barrier., Australia, CRC Press, , 216 p. (ISBN 978-90-5702-032-2, lire en ligne)
- (en) D. J. Begley et coll., The Blood-brain Barrier and Drug Delivery to the CNS., New York, Informa Health Care, , 264 p. (ISBN 978-0-8247-0394-3, LCCN 00024059)
- (de) P. Ramge, Untersuchungen zur Überwindung der Blut-Hirn-Schranke mit Hilfe von Nanopartikeln., Aix-la-Chapelle, Shaker Verlag, , 172 p. (ISBN 978-3-8265-4974-8)











