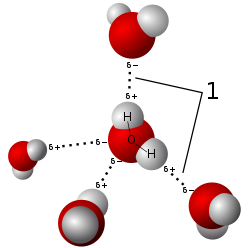
La liaison hydrogène ou pont hydrogène, parfois appelée liaison H ou pont H, est une liaison ou force intermoléculaire ou intramoléculaire impliquant un atome d'hydrogène lié à un atome électronégatif ou porteur d'une charge partielle, et un autre atome électronégatif porteur d'un doublet non-liant[1]. L'intensité d'une liaison hydrogène est intermédiaire entre celle d'une liaison covalente et celle des forces de van der Waals (en général les liaisons hydrogène sont plus fortes que les interactions de van der Waals). Elle possède une certaine directionnalité qui la distingue des interactions de van der Waals.
Pour qu'un pont H s'établisse, il faut être en présence d'un donneur de liaison hydrogène et d'un accepteur[2] :
- le donneur possède un H acide, c'est-à-dire un atome d'hydrogène lié à un atome possédant une charge partielle négative, généralement un hétéroatome (comme dans les amines, alcools, thiols) ;
- l'accepteur est composé d'un atome (souvent mais pas uniquement[2] d'azote, d'oxygène ou de fluor) porteur d'un doublet non liant, ou parfois impliqué dans un système π.
Lorsqu'une liaison hydrogène s'établit, les deux hétéroatomes se trouvent à une distance d'environ 0,25 nm.
Causes de la liaison hydrogène
La nature et la cause de la liaison hydrogène sont sujet encore aujourd'hui de controverses, alimentées en particulier par des résultats expérimentaux de la fin des années 1990 et des années 2000 à 2010[3].
On pensait à l'origine que l'électron de l'atome d'hydrogène était partagé entre les molécules liées, et donc que cette liaison hydrogène était quasi-covalente[4].[Information douteuse] Ceci semble pourtant contrevenir à la règle du duet, et pour cette raison cette description était rejetée par Linus Pauling qui lui préférait une description électrostatique[3].
La description classique est donc celle d'une liaison électrostatique due à la polarité de certaines liaisons entre un atome d'hydrogène et un autre atome plus électronégatif. Si on prend l'exemple d'une molécule d'eau, l'atome d'oxygène étant plus électronégatif que les deux atomes d'hydrogène, celui-ci attirera plus les électrons engagés dans les liaisons covalentes vers lui que les atomes d'hydrogène à ses côtés. Ceci fait que l'atome d'oxygène possèdera alors deux charges négatives partielles, alors que chaque atome d'hydrogène possèdera une charge partielle positive. La molécule est alors polarisée à cause de cette différence de charge, car les barycentres de ses charges partielles ne sont pas confondus (auquel cas elle serait apolaire). Cette polarisation locale fait que les pôles positifs (les atomes d'hydrogène) sont attirés par des entités de charge négative (anion, charge partielle, etc.). La molécule d'eau peut donc donner deux liaisons hydrogène à d'autres molécules et peut également en recevoir, ce qui fournit à l'eau nombre de ses propriétés particulières.
Cette description conduit à penser que les liaisons hydrogène sont causées uniquement par les différences d'électronégativité entre les différents atomes qui constituent les molécules, donc un simple cas particulier de force de London. Mais elle n'explique pas totalement la directionnalité des liaisons H ni pourquoi elles se dirigent vers des orbitales pleines jusque-là considérées comme non-liantes. On sait aujourd'hui que la liaison H est en grande partie électrostatique, mais aussi en partie covalente car le doublet non liant de l'accepteur s'étend jusqu'à l'atome d'hydrogène[5], ce qui se traduit par un allongement de la liaison covalente du donneur qui tient l'atome d'hydrogène et donne la direction de la liaison H.[3]
Conséquences de la liaison hydrogène
La liaison hydrogène s'établit alors entre toutes les molécules présentant les caractéristiques précédemment évoquées ; on considère par exemple le cas d'un acide carboxylique (R-COOH).

On remarque que toutes les molécules sont liées entre elles au niveau de la fonction alcool. Le radical alkyl « R » aura alors une influence non négligeable sur la force de cette liaison. En effet, la longueur de la chaîne et sa composition vont polariser de façon plus ou moins marquée la liaison entre l'hydrogène et l'oxygène. Si la liaison H (comme on l'appelle plus couramment) est affaiblie, la cohésion inter-moléculaire le sera également et la température d'ébullition de la substance en question sera plus faible. Autrement dit, il faudra moins d'énergie (par le biais de la chaleur) pour séparer les molécules les unes des autres. Au contraire, pour l'eau (H2O), l'ammoniaque (NH3 aqueux) ou le fluorure d'hydrogène (HF), la liaison X-H est tellement polarisée que les liaisons H qui s'établissent confèrent aux substances des points d'ébullition anormalement élevés.
Une autre illustration peut être celle de l'eau solide (glace). En effet, la molécule d'eau est l'exemple typique de la liaison H. Les liaisons H s'établissent, de sorte que l'état liquide de l'eau est l'état le plus compact, tandis que pour la plupart des autres corps purs c'est l'état solide. Dans la glace, l'eau a la même structure tétraédrique (structure rendue possible par ces liaisons) que dans l'eau liquide mais elle prend un volume plus important. C'est pourquoi la glace occupe plus de volume que l'eau, en quantités égales (le glaçon flotte sur l'eau) et c'est aussi pourquoi la glace fond plus vite que l'eau ne devient solide.

Enfin — et bien que la liste ne puisse être exhaustive tant le domaine d'application de cette liaison est vaste — on mentionnera le cas des polymères, tels le poly-para-phénylène téréphtalamide (plus connu sous le nom de Kevlar). Les chaînes de polymères s'attachent entre elles par des liaisons H lui conférant ainsi ses propriétés si intéressantes de résistance.
Typologie
On distingue en général trois types de liaisons hydrogène[7] (sachant que les doublets covalents font entre 100 et 500 kJ/mol) :
- faibles avec des enthalpies de liaison situées entre 1 et 4 kcal/mol :
- les liaisons hydrogène de cette intensité sont semblables aux forces de van der Waals. Elles sont de catégorie électrostatique. Dans une interaction de ce type, la distance entre les atomes se situe entre 2,2 et 4,0 Å et l’angle que forment ces liaisons se situe entre 90° et 150°,
- les meilleurs exemples de laisons hydrogène faibles sont les dimères en phase gazeuse contenant certains acides faibles et les systèmes dans lesquels on retrouve des liaisons C—H˖˖˖O/N et O/N—H˖˖˖π ;
- modérées avec des enthalpies situées entre 4 et 15 kcal/mol :
- étant donné que ce type de liaisons se situe entre les deux extrêmes, leurs propriétés ont des valeurs médianes : une longueur de liaison située entre 1,5 et 2,2 Å et des angles de 130° à 180°,
- tous les acides carboxyliques, les alcools, les phénols, les « hydrates » et molécules biologiques comprennent des liaisons hydrogène modérées ;
- fortes avec des enthalpies situées entre 15 et 40 kcal/mol :
- semblables aux liaisons covalentes, les liaisons hydrogène fortes constituent des interactions plus rapprochées, soit de 1,2 à 1,5 Å. Les angles que forment ces liaisons sont de 175°-180° donc plus grands que ceux des liaisons faibles,
- les « dimères » en phase gazeuse contenant des acides forts, des sels acides, des « éponges à protons », des « pseudohydrates » et des complexes HF en sont de bons exemples.
Un exemple de liaison très forte est FH–F− dans KHF2 avec environ 212 kJ/mol. On peut penser que dans ce cas il vaut mieux écrire F–H–F. La distance totale entre F–H–F est de 2,49 Å seulement et il se forme un angle de 120° entre les différentes molécules.
Propriétés des liaisons hydrogène
Trois grandes caractéristiques définissent les liaisons hydrogène ainsi que leur interactivité :
- Les liaisons hydrogène sont des liens intermoléculaires dont les atomes constitutifs respectent une certaine directionnalité. Dans un réseau de liaisons H, leur architecture est donc très optimisée. Cette propriété des liaisons H permet à l’eau de cristalliser de façon définie pour se changer en glace. Les conditions de refroidissement affectent la géométrie du réseau cristallin de la glace. Ces interactions sont aussi responsables des propriétés remarquables de la glace et de l'eau : diminution du volume à la fusion et densité maximale à 4 °C. En conséquence, la glace flotte sur l’eau liquide ;
- Due à leur intensité plus faible, les liaisons hydrogène peuvent se modifier à température ambiante, contrairement aux liaisons covalentes. En effet, à environ 27 °C, les liaisons H peuvent évoluer en se modifiant par bris ou formation de nouvelles interactions. C’est de cette flexibilité qu’ont besoin, entre autres, les molécules biologiques afin d’être en constante évolution. Cette propriété est également indispensable à la solubilisation des espèces hydrophiles dans l’eau. Plusieurs molécules d’eau contiennent suffisamment de liaisons hydrogène souples à température ambiante, pour former une « cage » flexible de solvatation autour des ions afin de les empêcher de former d’autres liens avec différents ions de charge opposée ;
- Les structures secondaires des protéines, comme l’hélice alpha et le feuillet beta, sont formées grâce à un agencement spécifique de liaisons H. Ces structures secondaires sont reliées les unes aux autres par des boucles de forme non définie pour former une structure tertiaire. Les hélices de l’ADN sont également maintenues par des liaisons hydrogène. On peut donc supposer que les liaisons hydrogène dans l’eau et dans les protéines auraient joué des rôles cruciaux dans le développement de la vie sur Terre et même de son apparition.
Notes et références
- ↑ (de) Elangannan Arunan, Gautam R. Desiraju, Roger A. Klein et Joanna Sadlej, « Definition of the hydrogen bond (IUPAC Recommendations 2011) », Pure and Applied Chemistry, vol. 83, no 8, , p. 1637–1641 (ISSN 1365-3075, DOI 10.1351/PAC-REC-10-01-02, lire en ligne, consulté le )
- (en) Guy V. Lamoureux et Katherine Chaves-Carballo, « Teaching hydrogen bridges: it is not FON anymore! », Chemistry Teacher International, vol. 6, no 3, , p. 177–187 (ISSN 2569-3263, DOI 10.1515/cti-2023-0027, lire en ligne, consulté le )
- (de) Elangannan Arunan, Gautam R. Desiraju, Roger A. Klein et Joanna Sadlej, « Defining the hydrogen bond: An account (IUPAC Technical Report) », Pure and Applied Chemistry, vol. 83, no 8, , p. 1619–1636 (ISSN 1365-3075, DOI 10.1351/PAC-REP-10-01-01, lire en ligne, consulté le )
- ↑ Alain Gerschel, Liaisons intermoléculaires : Les forces en jeu dans la matière condensée, Paris, EDP Sciences, , 2e éd., 288 p. (ISBN 978-2-7598-0278-4, lire en ligne), p. 12.
- ↑ (en) T.W. Martin et Zygmunt S. Derewenda, « The name is bond — H bond », Nature Structural Biology, vol. 6, no 5, , p. 403-406 (DOI 10.1038/8195, lire en ligne).
- ↑ Y. Maréchal et A. Witkowski, J. Chem. Phys., 48, 3697, 1968.
- ↑ (en) Thomas Steiner, « The Hydrogen Bond in the Solid State », Angew. Chem. Int., , p. 48-76 (DOI 10.1002/1521-3773(20020104)41:1<48::AID-ANIE48>3.0.CO;2-U).
Voir aussi
Articles connexes
Liens externes
- Yves Maréchal, « La liaison hydrogène » (consulté le )
Bibliographie
- Jane B. Reece, Lisa A. Urry, Michael L. Cain, Steven A. Wasserman, Peter V. Minorsky et Robert B. Jackson, Campbell Biology, 9e éd., chap. 3 (ISBN 978-0321558237)
- (en) A. Jeffrey, G., An introduction to hydrogen bonding, Series Editor, , p. 11-14
- O. Henri-Rousseau et P. Blaise, Adv. Chem. Phys., 103, 1998, 1-186.








